INTRODUCCIÓN
La diatomita, de amplia difusión en el mercado, a lo largo del tiempo ha tenido aplicaciones en: adhesivos, fertilizantes, insecticidas, pulimentos, pinturas, piedras, aislantes y refractarios, plásticos y otros (1,2). Este material presenta muy buenas propiedades siendo algunas de estas su alta porosidad, su resistencia a las altas temperaturas y su capacidad de absorber líquidos.
El presente trabajo tiene como objetivo ver la capacidad de adsorción de oro en la tierra diatomea en el proceso de clarificación de soluciones Pregnant en el proceso Merril Crowe (3); dicha solución proviene de la lixiviación de mineral aurífero el cual contiene sólidos en suspensión y otros minerales que causan la pasivación del zinc.
En el momento de clarificación de la solución inicial deben disminuirse sus NTU (<1 ppm de sólido) para lograr una mayor eficiencia en la cementación y obtener mejor ley en los precipitados; por lo tanto, dicha adsorción genera una pérdida de oro en la solución afectando la ley de cabeza y no se obtiene lo calculado en la planta.
EXPERIMENTAL
Sinterizaciòn de la diatomita
Se realizó el lavado de la diatomita con agua destilada para eliminar impurezas. Se secó la muestra por 2 horas a 150°C en un horno. Según Galán et al (4) se pesa 20 gr de muestra en un crisol, para luego cocerla a 700°C en mufla con la finalidad de sinterizar la muestra. Se procedió a pulverizar la diatomita para obtener una granulometría.
Agitación en botellas para la adsorción
Se pesó 20 gr de la diatomea sinterizada, se colocó la muestra dentro de la botella de agitación y se añadió un litro de solución rica. Se procedió a programar los rodillos a la velocidad apropiada y por el tiempo requerido. Las muestras se leyeron en el área de Instrumentación. Culminado el tiempo de agitación se procedió a retirar la diatomea por sedimentación en una bandeja, la solución pobre es mandada a reproceso y la muestra de diatomea cargada de hace secar por 1 hora a 150°C.
Lectura en equipo de absorción atómica
Se utilizó el equipo según Gaytán (5) calentado por 30 minutos. Se prendió el extractor de gases del equipo. Se encendió la llama del equipo y se procedió a realizar las lecturas de las muestras. Se anotó el valor de las lecturas en su respectivo código de muestra.
Análisis en ensayos al fuego
Pesado de la muestra
Se pesaron las muestras en la balanza analítica Sartorius de sensibilidad 0.0001, se le añadió 2g de harina para muestras geoquímicas oxidadas. Se agregaron reactivos reductores y oxidantes, para obtener una buena fusión y un regulo de 30 g. En total son 13 crisoles de las cuales, 11 son de oro y 2 muestras blanco.
Dosificación y Homogenización
Se ordenaron las muestras y se codificaron, se añadió el fundente a cada muestra, aproximadamente 238 g de mezcla fundente y homogenizamos
Fundición
Una vez homogenizada la muestra (5 g) más el fundente y colocado al crisol, se procedió al cargado de los crisoles y luego al al horno de fundición de izquierda a derecha, la muestra debe ser fundida a 1100ºC, la temperatura deberá ser incrementada lentamente en los últimos 30 minutos de fusión. El vaciado es en lingoteras de fierro fundido de forma de cono invertido. El plomo es vació a través de la escoria derretida dentro del molde, esto protege el plomo de salpicarse por las paredes del molde.
Copelación
Las copelas se secaron por el lapso de 15 minutos a 950ºC para eliminar toda traza de humedad que pueda existir. El 98.5 % el PbO es absorbido por la copela, el resto se volatiliza. Queda como residuo el dore, formado por metales inoxidables como el oro.
Partición
Una vez frías la copelas, se separó el dore con un alicate punta de loro, se colocó en crisoles de porcelana codificados, que se emplazaron en la plancha a una temperatura de 100°C, se realizó un primer ataque con 10 mL de HNO3 concentrado a 1/6 de dilución hasta el término de la reacción (cambio de color); después se pasaron todos los crisoles a una plancha a una temperatura de 200 °C por media hora añadiendo 10 mL HNO3 concentrado.
Se lavó dos veces el botón de oro con agua destilada para separar el HNO3; dichas copelas se colocaron al horno por 5 minutos a 500° C para obtener el color y brillo correspondiente del oro. Se pesó cada muestra obtenida en una balanza METTLER AT20 (microgramos).
Caracterización de la diatomita
Una vez obtenidos los resultados de los análisis se eligió la muestra con mayor adsorción de oro y se llevó a caracterizar mediante Microscopio Electrónico de Barrido (SEM) (6). Las muestras en polvo fueron colocadas en el stap con cinta de fibra de carbono dentro del metalizador SPI-MODULE.
El metalizado se realizó en un tiempo de 1 minuto a 18 mA y 10-1 torrens.
Las muestras metalizadas se llevaron al Microscopio Electrónico de Barrido de la Universidad Nacional Mayor de San Marcos de Lima para las fotografías. Las fotografías se toman con diferentes resoluciones, las más importantes (5000x) se toman con la diatomita activada y saturada.
Análisis factorial
Para el análisis factorial y la obtención de la ecuación de regresión de remoción de Cr (VI) se utilizó el método factorial con replica en el punto central.
RESULTADOS Y DISCUSIÓN
Análisis estadístico
Se realizó el diseño factorial 2k con 3 réplicas centrales teniendo en cuenta lo siguiente:
Factores: 3 Diseño de la base: 3, 8
Pruebas: 11 Réplicas: 1
Bloques: 1 Puntos centrales: 3
En la tabla 1, podemos observar las variables del experimento. Se pudo obtener la concentración final a partir del diseño factorial.
Resultados de la matriz
Según las lecturas obtenidas por el equipo de absorción atómica:
La tabla 2 muestra los valores de las variables codificando el modelo del diseño experimental, notándose un alto nivel de adsorción, verificándose la eficiencia del método empleado de acuerdo a la matriz experimental.
En la Fig. 4 se observa la imagen SEM de la diatomita natural (Fig.4A) y las frústulas activadas térmicamente con nanotubos con tamaños entre 8,602 μm y 1,829 μm de forma céntrica, antes de la adsorción. Además, las partículas de diatomitas presentan una aglomeración de nanocristales tanto en el nanotubo, como en la superficie después de la adsorción con un contenido de Au (Fig. 4B).
En la tabla 3 se muestra un nivel de significancia del 5%, concluyéndose que existe una influencia sifnificativa del factor b (agitación) y en el porcentaje de Adsorción de Au. Por otro lado, se acepta la hipótesis nula para el tiempo y pH, así como las interacciones dobles y triples, es decir, que las interacciones no tienen efecto significativo sobre el porcentaje de adsorción del Au. Esto, nos indica que para la agitación de 60 rpm existe una mayor adsorción sin importar la variación del pH y el tiempo de adsorción como se muestra en las pruebas N°3 y N°8 (Tabla N°2).
Estimación de los Efectos de los Factores e Interacciones
Análisis de varianza
El análisis estadístico, fue realizado con el programa Statgraphics, el cual se describe a continuación:
La tabla 3 muestra los efectos de los factores sobre la variable de respuesta, esto significa que el factor Agitación presenta un mayor efecto cuando cambia de un nivel inferior a uno superior y aumenta en 0.62 de la variable medida. Sin embargo, el factor Tiempo no tiene un efecto significativo. Cuando el pH cambia sus niveles de más ácido a más básico, la variable respuesta disminuye en 0.035. Este efecto de los factores principales se ve reflejado en la Interacción: Tiempo, Agitación y Ph, que indica que la variable medida aumenta en 0.335.
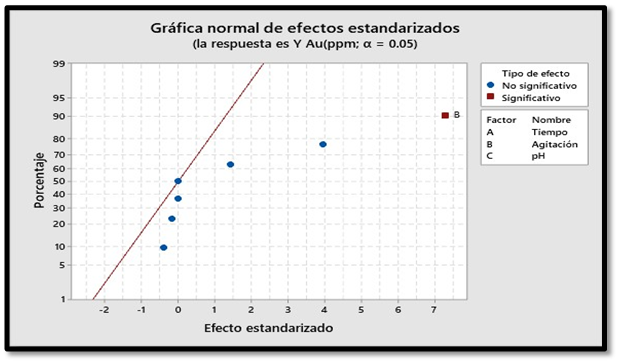
En la figura 5 se observa que aquellos factores que no atraviesen la línea roja no tendrán efecto significativo en la variable de respuesta. El efecto B es el que tiene mayor efecto sobre la variable respuesta y no tienen efecto de los otros factores principales A y C ni tampoco de las Interacciones dobles y triples.
En la figura 6 se cuenta con un nivel de significancia del 5%. Podemos afirmar que cuando el factor B de Agitación trabaja a niveles bajos (-) la media de ppm de Au es bajo y cuando este factor trabaja a nivel alto (+) es mayor, es decir que él % de adsorción se ve influenciado por el menor nivel agitación dado que se tiene menor.
La figura 8 la representa la interacción múltiple de los factores. Claramente se observa que cuando el nivel del factor agitación es bajo y el tiempo es bajo el valor medio de la variable respuesta también es menor. Además, podemos notar que cuando el nivel del factor agitación es bajo (50) y el pH es alto (11) el valor medio de la variable también es menor.
La figura 7 presenta una línea de referencia, que significa que aquellos factores que están alejados de esta línea no tienen significancia.
En la Tabla 5, “S” representa a la desviación estándar agrupada y “R-cuad” nos indica que el 97.79% de los datos están representados por este modelo.
Ecuación de regresión en unidades no codificadas
Del análisis del diseño experimental se obtuvo el modelo matemático para la adsorción del Au.
Y Au (ppm) = -256.3 + 37.62 Tiempo + 5.01 Agitación + 24.94 ph - 0.707 Tiempo* Agitación - 3.565 Tiempo * pH - 0.469 Agitación * pH + 0.0670 Tiempo * Agitación * pH + 0.3408 Pt Central
La figura 9 es la superficie de respuesta donde el color rojo representa cuantificación de la variable Au (ppm) entre 10, 5 y 10.6 ppm; y el color verde representa combinaciones de agitación y pH valores < de 9.9 ppm de Au.
CONCLUSIONES
Se demostró por absorción atómica que la diatomea tiene una adsorción de Au de 10.82 ppm. El proceso de agitación tiene mayor influencia porque aumenta la adsorción de oro.
A pH 10 se observó una mayor adsorción por la formación de complejos de oro con el ácido cianhídrico (HCN).
El poder de adsorción de la diatomita frente al oro se da ya que terminado el proceso se puede comparar en las tomas fotográficas y después de la adsorción del oro.












 uBio
uBio