Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Alfa Revista de Investigación en Ciencias Agronómicas y Veterinaria
versión On-line ISSN 2664-0902
Rev. Inv. Cs. Agro. y Vet. v.4 n.12 La Paz dic. 2020
https://doi.org/10.33996/revistaalfa.v4i12.88
INVESTIGACIONES
Análisis de inóculos microbianos para la optimización de la
producción de biogás a partir de fangos residuales
Analysis of microbial inoculants for the optimization of biogas
production from slaughterhouse mud
Análise de inóculos microbianos para otimização da produção
de biogás a partir de lodo residual
Andrés Sandoval T.1![]() , Fernando Santacruz F.2
, Fernando Santacruz F.2![]() , David Chuquer S.3
, David Chuquer S.3![]()
Diana Astorga G.4![]()
1 Pontificia Universidad Católica del Ecuador, Ecuador
asandoval226@hotmail.com
2 Pontificia Universidad Católica del Ecuador, Ecuador
frsantacruz@puce.edu.ec
3 Pontificia Universidad Católica del Ecuador, Ecuador Universidad
Central del Ecuador; Ecuador dchuquer295@puce.edu.ec
4 Correspondencia: Pontificia Universidad Católica del Ecuador,
Ecuador dastorgal99@puce.edu.ec
Artículo recibido: 31 de agosto 2020 / Arbitrado y aceptado: 4 de noviembre 2020 / publicado: 18 de diciembre 2020
Resumen
La necesidad de manejo adecuado de desechos en camales de parroquias rurales y su posible utilización como fuente de energía renovable, que además detenga el deterioro ambiental, condujo a la búsqueda de tecnologías microbianas. Residuos como visceras, sangre y heces son ricos en sustratos esenciales para producir biocombustible. Con el objeto de confeccionar inóculos microbianos que optimicen la producción de biogás a partir de fangos residuales de desechos de camal de una parroquia rural del Distrito Metropolitano de Quito, se analizaron cantidad y calidad de biogás producido por consorcios intactos y cepas microbianas aisladas a partir de nueve estratos de 15 cm de espesor acumulados en el gradiente vertical de un colector de residuos de camal de 135 cm de profundidad. Dos de siete cepas productoras de biogás del total de 36 cepas microbianas aisladas y un consorcio intacto produjeron metano en concentraciones mayores al 87% tras 28 días de incubación. Al evaluar los inóculos metanogénicos generados con todas las combinaciones posibles entre estas dos cepas y el consorcio, uno de los inóculos fabricados registró no sólo la más alta producción de biogás, sino un 95,17% de pureza en términos de concentración de metano. Por tanto, la generación de inóculos metanogénicos a partir de cepas y consorcios eficaces puede conducir a la optimización de procesos de biodigestión con vías al aprovechamiento energético de residuos de camal.
Palabras clave: Biogás; consorcio microbiano; desechos orgánicos; eficacia metanogénica, inóculos metanogénicos
Abstract
The need of an appropriate management of slaughterhouse waste and its possible use as a renewable energy source in rural territories, which could also stop environmental deterioration, led to microbial technologies. Viscera, blood and feces are rich in essential substrates for biofuels. In search for enhanced metanogenic efficiency of slaughterhouse waste in a rural Parrish of the Metropolitan District of Quito, microbial inoculants were investigated. Quality and quantity of biogas produced by intact consortia and isolated microbial strains from nine 15 cm-thick layers of mud in the vertical gradient of a waste collector were examined. Two of the seven strains that produced biogas of a total of 36 isolated microbial strains and a consortium produced more than 87%-methane biogas after 28 days of incubation. Within all possible combinations of these two strains and the consortium, one of the confectioned microbial inoculants produced not only the higher quantity of biogas: it also reached a methane purity of 95.17%. Therefore, the generation of microbial inoculants with efficient methanogenic strains and consortia may optimize the biodigestión processes leading to energetic exploitation of slaughterhouse mud.
Keywords: Biogas; methanogenic efficiency; methanogenic inoculum; microbial consortium, organic waste
Resumo
A necessidade de urna gestão adequada dos residuos nos leitos rurais das freguesias e a sua possível utilização como fonte de energía renovável, o que também impede a degradação ambiental, motivou a procura de tecnologías microbianas. Resíduos como carnes de órgãos, sangue e fezes são ricos em substratos essenciais para a produção de biocombustíveis. Para fazer inoculos microbianos que otimizam a produção de biogás a partir de lodo de residuos de matadouro de urna freguesia rural no Distrito Metropolitano de Quito, estudaram-se a quantidade e qualidade do biogãs produzido por consorcios intactos e cepas microbianas ¡soladas de nove estratos de 15 cm de espessura acumulados no gradiente vertical de um coletor de residuos de matadouro com 135 cm de profundidade. Duas das sete cepas produtoras de biogás de um total de 36 cepas microbianas ¡soladas e um consorcio intacto produziram metano em concentrações superiores a 87% após 28 dias de incubação. Ao avaliar os inoculos metanogénicos gerados com todas as combinações possíveis entre essas duas linhagens e o consorcio, um dos inoculos fabricados registrou não apenas a maior produção de biogás, mas também 95,17% de pureza em termos de concentração de metano. Portanto, a geração de inoculos metanogénicos a partir de linhagens e consorcios eficientes pode levar á otimização dos processos de biodigestão com formas de aproveitamento energético dos residuos de abatedouro.
Palavras-chave: Biogás; consorcio microbiano; residuo orgânico; eficiência metanogênica; inóculo metanogênico
INTRODUCCIÓN
Pacto es una comunidad rural del noroccidente del Distrito Metropolitano de Quito, Ecuador, localizada en una de las zonas calientes de biodiversidad declarada como Reserva de Biosfera de la UNESCO en 2018. La necesidad de un manejo adecuado y responsable de desechos agroindustriales, de camal y aguas negras en esta parroquia rural y su posible utilización como fuente de energía renovable que, a la vez, detenga el deterioro ambiental, condujo a la búsqueda de tecnologías microbianas. Según el Plan de Desarrollo y Ordenamiento Territorial de la Parroquia de Pacto (1), hasta 2015, solo la zona centro poseía servicio de alcantarillado y únicamente el 27,7% de las viviendas mantenía un manejo, aunque precario, de aguas negras. De esta manera, problemas ambientales y enfermedades en sus habitantes relacionados al mal manejo de desechos han obligado a entidades como la Agencia de Regulación y Control Fito y Zoosanitario de Ecuador (Agrocalidad) a normar y controlar el cumplimiento de la normativa aplicable (1,2).
Sin embargo, la observancia normativa resulta poco real en algunos aspectos como aquellos abordados en la resolución DAJ-20134B4-0201.0247, emitida en 2013 por el Ministerio de Agricultura, Ganadería, Acuicultura y Pesca de Ecuador (2). Se resolvió que, para obtener carne procedente de ganado vacuno, ésta debía ser faenada en un camal con los permisos de funcionamiento y el manejo de desechos pertinentes; caso contrario, el producto no podría ser comercializado. En Pacto, el ganado faenado es básicamente para el consumo directo de la comunidad (3) y los pequeños ganaderos no tienen capacidad de mayor inversión en transporte y permisos de comercialización para la producción de carne (1,2,3).
Además, el camal de Pacto no contaba con los requerimientos básicos para faenar las reses (4). Gran parte del problema radicaba, precisamente, en un sistema deficiente de manejo de desechos. Se consideraba satisfecha su gestión con acumularlos en una cisterna anaerobia que liberaba los gases producidos directamente a la atmósfera, además de lixiviados que se filtraban al suelo y desembocaban en la quebrada aledaña. El problema se magnificó cuando dicho colector se colmató en julio de 2016, tras cerca de seis años de uso. Esto planteó nuevos retos como ¿qué hacer con los desechos acumulados? y ¿cómo disponer de los nuevos? Se requería de una solución inmediata para mejorar el manejo de desechos del camal de la parroquia, que a la vez le proporcionara una alternativa replicable de gestión de desechos humanos en general. En este contexto, la optimización de procesos de biodigestión para la obtención de biogás a partir de desechos orgánicos surgió como una iniciativa viable.
La solución biotecnológica aportada por la producción de biogás a nivel familiar e industrial, a través de biodigestores alimentados con desechos orgánicos de origen animal o vegetal, ha demostrado su valía como opción sostenible alrededor del mundo, cuando tanto el sistema de montaje como la diversidad microbiana involucrados en el proceso de biodigestión son los adecuados (5). No obstante, las características de volatilidad del biogás, su poder calorífico, las impurezas gaseosas y/o la dependencia en cantidad y calidad de sustrato orgánico para su producción condicionan su viabilidad para suplir determinadas demandas energéticas que, por ejemplo, el gas licuado de petróleo sí concreta (6,7,8). A pesar de ello, un correcto manejo y estimulación de vías metabólicas microbianas puede conducir a la optimización del biogás producido en biodigestores para un suministro adecuado de biocombustible (9).
Varios estudios han demostrado la factibilidad de rentabilizar la producción de biogás. El estudio de Kallio (9), por ejemplo, demostró que la inserción de genes reguladores de funciones metabólicas específicas para diferentes sustratos provenientes Anaerococcus tetradius o Procholorococcus marinus en Escherichia coli puede maximizar la obtención de propano. Una de las características del propano es que tiene el doble de poder calorífico que el metano. Por esta razón, la producción de propano por vías metabólicas microbianas es considerada una de las formas más eficaces de optimizar procesos de biodigestión para la generación de energías renovables eficientes y autogestionadas que reemplacen a hidrocarburos de origen fósil (9,10). No obstante, economías rurales no están en capacidad de adquirir tecnología de punta como la que requiere la modificación genética de cepas microbianas para aprovechar sus desechos en la producción de biocombustibles.
Una forma más viable para la realidad socioeconómica de una parroquia rural latinoamericana como Pacto resulta la composición y bioaumentación de inóculos microbianos generadores de metano. Estudios de Schlüter (11) revelan características de perfiles metabólicos fermentativos, que permiten entender la relación estrecha que existe entre los microorganismos que participan en los procesos enzimáticos de la metanogénesis para optimizar recursos biológicos y tecnológicos en la producción de biocombustibles. Efectivamente, el metano, uno de los componentes mayoritarios del biogás (55%), es un biocombustible eficiente producido por el metabolismo de consorcios microbianos degradadores de compuestos orgánicos (12). Existen géneros microbianos cultivables en laboratorio claves en la metanogénesis como: Bacillus spp., Clostridium spp., Methanococcus spp., Methanobacterium spp., Lactobacillus spp., Thermus spp., Thermococcus spp., Bifldobacterium spp., Propionibacterium spp., Fusobacterium spp. y Micrococcus spp. (13,14). Sin embargo, con la presencia de una mayor variedad de microorganismos distribuidos en las clases Methanobacteria, Methanococci, Methanomicrobiota, Methanopyri y Methanosarcinales, mayoritariamente cultivables, se asegura la maximización de la producción de biocombustible (15,16), de manera que se logre satisfacer demandas energéticas a pequeña, mediana o gran escala (6).
Uno de los estudios más relevantes en Ecuador sobre optimizacion de desechos orgánicos para la generación de biogás a partir de biodigestores es la de Garzón et al. (17). El suministro de diferentes sustratos para el desarrollo de microorganismos metanogénicos fue el mecanismo utilizado para promover la producción de metano, destacándose especialmente el medio mineral con acetato. No obstante, una descripción de la biodiversidad microbiana o los consorcios implicados puestos a prueba no fue provista.
Un consorcio microbiano resulta de la asociación de varias especies de microorganismos presentes en determinado nicho ecológico, con la finalidad de desempeñar funciones metabólicas interrelacionadas y procesos específicos para su sobrevivencia, que generan productos finales y/o subproductos metabólicos específicos (14). De esta manera, un consorcio microbiano puede ser considerado como tal de acuerdo al ecosistema en el que se encuentre. En el caso de procesos de biodigestión anaerobia, donde uno de los subproductos finales es el metano, resulta fundamental que los consorcios microbianos estén compuestos de especies capaces de metabolizar desechos orgánicos mediante hidrólisis, acidogénesis, acetogénesis y metanogénesis (17), cuyos sustratos intermedios de mayor interés son la glucosa, el propio nato, el formiato y el acetato (18). Por tanto, para que un inoculo microbiano pueda generar gas metano eficientemente, debe estar compuesto por al menos un tipo de microorganismo que degrade alguno de los sustratos antes mencionados (13,14).
Por otro lado, la importancia de consolidar inoculos microbianos generadores de metano cultivables en laboratorio radica en las varias ventajas que presentan. Entre estas, se encuentran la maximizacion de la producción de metano sin una generación paralela de dióxido de carbono de igual magnitud (11), la optimizacion de recursos en cuanto a infraestructura e insumos (17), la posibilidad de bioaumentar consorcios microbianos con sustratos caseros y de bajo costo (14) y una mayor degradación de desechos orgánicos (11). De hecho, estudios de co-digestión anaerobia a partir de residuos de camal (19) revelan que los microorganismos involucrados en la metanogénesis están estrechamente relacionados entre sí precisamente para maximizar la producción de metano y realzan el potencial de aprovechamiento de este tipo de desechos.
Los residuos de camal tienen altas concentraciones de sustratos ricos en proteínas, lípidos, ácidos grasos, almidones, celulosa, entre otros, y, mientras estén en reposo por largos periodos, la riqueza biológica es más abundante y estable. Los estratos o capas de sedimentación de masa biológicamente activa que se forman presentan una actividad y diversidad microbiana que puede variar con la profundidad a la que se encuentren. De esta manera, gran variedad de microorganismos generadores de metano presentes en residuos de matadero podrían ser cultivables en laboratorio, en vista de que los sustratos que estos degradan son replicables en medios de cultivo (20).
En este contexto, la alternativa que propuso esta investigación para solventar los problemas de gestión de desechos animales y humanos de la parroquia de Pacto fue el uso de inoculos microbianos capaces de optimizar la producción de metano a partir de dichos desechos, de manera que se consiguiera mejorar las características del biogás obtenido como para satisfacer parte de la demanda energética de la comunidad (21), utilizando como base la microbiota contenida en la cisterna colectora de desechos de camal. Por ello, se propuso aislar la mayor cantidad de especies microbianas cultivables presentes en el fango residual con el fin de combinarlas, de acuerdo a sus propiedades metanogénicas, determinar el consorcio natural o el inoculo construido más eficiente en la producción de biogás y aportar nuevos datos sobre especies y consorcios microbianos asociados a la biodigestión anaerobia. Esto planteó un problema de investigación clave: ¿cómo constituir inóculos microbianos productores de biogás a partir de fangos residuales? De esta interrogante surgieron cuestionamientos secundarios como: ¿cuántas de las especies microbianas idóneas son cultivables?, ¿cuántas especies deben incluirse para generar un inoculo microbiano efectivo?, ¿qué medios de cultivo o sustratos son aptos para el mantenimiento de estos microorganismos? y ¿en qué tiempo un inoculo microbiano es capaz de producir la suficiente cantidad y calidad de biogás para suplir una determinada necesidad energética? Estas y otras interrogantes fueron resueltas mediante esta investigación.
MATERIALES Y MÉTODOS
Área de estudio
La parroquia de Pacto se ubica en las estribaciones de la cordillera occidental de los Andes ecuatorianos, con altitudes desde los 440 hasta los 1850 m.s.n.m. Esta zona conserva un 50% de bosques húmedos originales y se encuentra dentro de dos puntos calientes de biodiversidad (1,4). Los problemas de deforestación han conducido a estrategias mancomunadas de conservación de la biodiversidad y uso sustentable del territorio a nivel regional. Por tal motivo, se creó la Mancomunidad del Chocó Andino del Noroccidente de Quito y, posteriormente, el Primer Bosque Modelo de Ecuador (22,23).
Muestreo del colector de desechos de camal
Para el muestreo de fango residual de la cisterna colectora de desechos de camal, se diseñó un dispositivo basado en las características funcionales de recolección de muestras marinas por estratos de la roseta oceanógrafica (24). Se consideraron cuatro condicionantes: una profundidad de 135 cm de material acumulado, la consistencia viscosa del material a muestrear, el volumen requerido para los análisis y el hecho de que las muestras necesitaran ser tomadas simultáneamente de estratos consecutivos (3 L de cada uno de nueve estratos de 15 cm de espesor desde la base de la cisterna hasta la superficie) y por triplicado, en base a resultados de estudios similares en comunidades metanogénicas estratificadas (25). El dispositivo diseñado, cuyo funcionamiento se comprobó previo al muestreo, se esquematiza en la Figura 1. Se cumplieron estrictos protocolos de limpieza, desinfección, esterilización y control de mantenimiento tanto del dispositivo como de todos los equipos y materiales a utilizar en la Sala de Preparaciones de la Escuela Ciencias Biológicas de la Pontificia Universidad Católica del Ecuador (SP-ECB-PUCE).
Para el análisis microbiológico, exclusivamente, se tomaron por triplicado 10 mi de cada estrato en tubos cónicos herméticos previamente etiquetados. Se requirió de 1 mi de muestra por estrato para preparar cada uno de seis inóculos que se emplearían para los medios de cultivo líquidos y sólidos y mantener en almacenamiento 4 mi como respaldo (24). Los tubos se organizaron en gradillas y se apilaron dentro de una hielera a 4-8°C. El tiempo de transporte de las muestras no superó las 24 horas tras su colección y se las procesó inmediatamente después de su llegada al laboratorio (24,26).
Aislamiento e identificación macroscópica de cepas microbianas
Para el aislamiento, se utilizaron los medios Barker-Taha (MB) y Stadtman-Barker (MC) (13,27,28), a los que se añadieron formiato de sodio y cloruro de calcio como precursores y dihidroxiestreptomicina como antibiótico (13). Se los preparó de acuerdo al protocolo de Acuña et al. (27) y se pre-redujo su concentración de oxígeno mediante choque térmico. Para los medios sólidos, se añadió 2 g de agar-agar por cada 100 mi de medio de cultivo y se omitió el antibiótico (13,27).
Para asegurar la viabilidad de los microorganismos, previa su inoculación en los medios de cultivo específicos para metanogénicos, se aseguró la activación celular. Se colocó 1 mi de la muestra de cada estrato por triplicado en 10 mi de caldo tioglicolato y se llevó a incubación la solución durante al menos 24 horas a 37°C. Posteriormente, para obtener la mayor diversidad de colonias aisladas posible, se realizaron diluciones de cada pre-enriquecimiento microbiano, se inocularon 100 [il por triplicado de las diluciones 103 y 104 en agar sólido MB y MC y se los incubó durante 72 horas a 37°C en campana de anaerobiosis (26,27). Se realizaron los controles de calidad respectivos para garantizar la calidad de los resultados.
Recoge simultáneamente nueve estratos de 3 L cada uno, gracias a la palanca multiacción que abre a la vez todas las llaves de media vuelta para que el material ingrese a los frascos colectores.
El desarrollo microbiano, relativamente lento, requirió una revisión diaria de las cajas Petri inoculadas, con el fin de aislar y evitar la contaminación o pérdida de colonias de interés. La caracterización fenotípica de las cepas aisladas en los medios de cultivo sólidos MC y MB se ejecutó según Acuña et al (27) y Domínguez (13). Se detallaron características microscópicas y macroscópicas como: Gram (+ ó -), morfología de la colonia sobre el agar, motilidad y producción de biogás. Cada cepa aislada fue comparada con la caracterización fenotípica descrita para géneros microbianos metanogénicos como Methanocccus y Methanobacterium (27).
Determinación de cepas aisladas y consorcios intactos productores de biogás para la composición de inoculos microbianos potenciadores de la producción de metano
La determinación cualitativa de cepas productoras de biogás se realizó por triplicado según la metodología de Domínguez (13). Se utilizaron 20 mi del medio de cultivo con un inoculo ajustado de 107 UFC mi1 en un tubo de ensayo estéril con tapa de caucho en el que se incluyó un tubo Durham invertido. Se evidenció la producción de biogás por desplazamiento de volumen en medio líquido y los medios de cultivo utilizados para este propósito fueron MB y MC.
Se procedió de la misma manera para los consorcios intactos provenientes de los diferentes estratos de la cisterna, con la diferencia de que se inoculó 1 ml del consorcio en los respectivos medios específicos para metanogénicos anteriormente mencionados (13,26). Aquellas cepas y consorcios intactos que registraron producción de biogás fueron sometidos a un análisis de cantidad (en volumen) y calidad (en términos de porcentaje de metano) del mismo.
Para evaluar cuantitativamente la cantidad de biogás producido, se inocularon por triplicado en los medios MB y MC tanto cepas aisladas como consorcios, respetando volúmenes y concentraciones descritas anteriormente, esta vez dentro de tubos de vidrio con tapa perforable que permitieron conservar la hermeticidad pese a muéstreos sistemáticos de biogás mediante punción con jeringuilla. En el caso de consorcios intactos, se procedió a sembrar una segunda réplica del muestreo original por triplicado.
La medición de volúmenes de biogás producido se realizó de acuerdo a la metodología de Posada et al. (29): el biogás acumulado en el tubo hermético fue medido mediante punción con jeringuilla a los 7, 14, 21 y 28 días de crecimiento. Para consorcios intactos, se procedió con la medición del volumen a los 7 y 28 días (13), pero también se realizaron lecturas a los días 14 y 21 por motivo de comparaciones posteriores.
Paralelamente al estudio anterior, el biogás producido por cepas y consorcios intactos inoculados por triplicado en tubos de vidrio con tapa perforable fue utilizado para la determinación de la concentración de metano mediante el uso de un equipo VARÍAN 660-IR, según la metodología descrita por Figueredo (30), para el cálculo del porcentaje de metano en base a la absorbancia. En el caso de consorcios intactos, se contó con seis medidas provenientes del biogás producido por dos de las tres réplicas muestreadas por estrato que se inocularon por triplicado.
Se tomaron, mediante punción con jeringuilla, 15 cm3 del biogás producido (independientemente del volumen total) y se aforó a 50 cm3 con aire común para inyectar en las celdas de lectura y obtener las absorbancias de metano. Las lecturas del biogás producido por cepas aisladas y consorcios intactos se realizaron a los 7, 14, 21 y 28 días de crecimiento (13, 29). Previo a los análisis de concentración de metano contenido en el biogás, se calibró el equipo VARÍAN 660-IR ubicado en la Facultad de Ciencias Químicas de la Universidad Central del Ecuador con los estándares gaseosos de butano, propano, metano, ácido sulfhídrico y nitrógeno. Paralelamente a cada análisis de gases efectuado durante todo el estudio, se corrieron gases estándar provenientes de un cilindro Airgas UN 1954 y una muestra blanco para comprobar que los datos obtenidos fueran correctos.
Determinación de volumen y porcentaje de metano del biogás producido por inoculos confeccionados a partir de cepas y consorcios intactos más idóneos para potenciar la producción de metano en medio de cultivo específico
Un análisis estadístico de los resultados obtenidos en cuanto a cantidad y calidad del biogás producido tanto por cepas aisladas como por consorcios intactos permitió determinar cepas y consorcios más idóneos para la composición de inoculos microbianos potenciadores de la producción de metano, así como el medio más adecuado para cultivarlos.
Inoculos microbianos combinados pueden formarse a partir de dos cepas diferentes que cumplan determinada función de carácter simbiótico (31,32). Por tanto, se procedió a preparar los medios de cultivo adecuados para las cepas identificadas como mejores productoras, se inocularon por triplicado todas las combinaciones posibles entre éstas y el consorcio intacto más eficaz, y se procedió al análisis de la cantidad y la calidad del biogás producido por los nuevos inoculos generados.
Para la comparación del volumen de biogás producido y su concentración de metano entre cepas aisladas, consorcios intactos e inoculos fabricados a intervalos de siete días durante 28 días, se utilizó el programa IBM SPSS Statistics versión 22.0. Previo al análisis de varianza, se procedió a comprobar el cumplimiento de los supuestos del ANOVA. Todos los valores respetaron la normalidad, igualdad de varianzas y/u homogeneidad (33,34). Al registrarse diferencias significativas, se realizó un análisis Post Hoc mediante prueba de Tukey para destacar a los mejores productores de metano entre cepas aisladas, consorcios intactos e inoculos confeccionados.
RESULTADOS
Determinación de cepas aisladas y consorcios intactos productores de biogás de calidad para la composición de inoculos potenciadores de la producción de metano
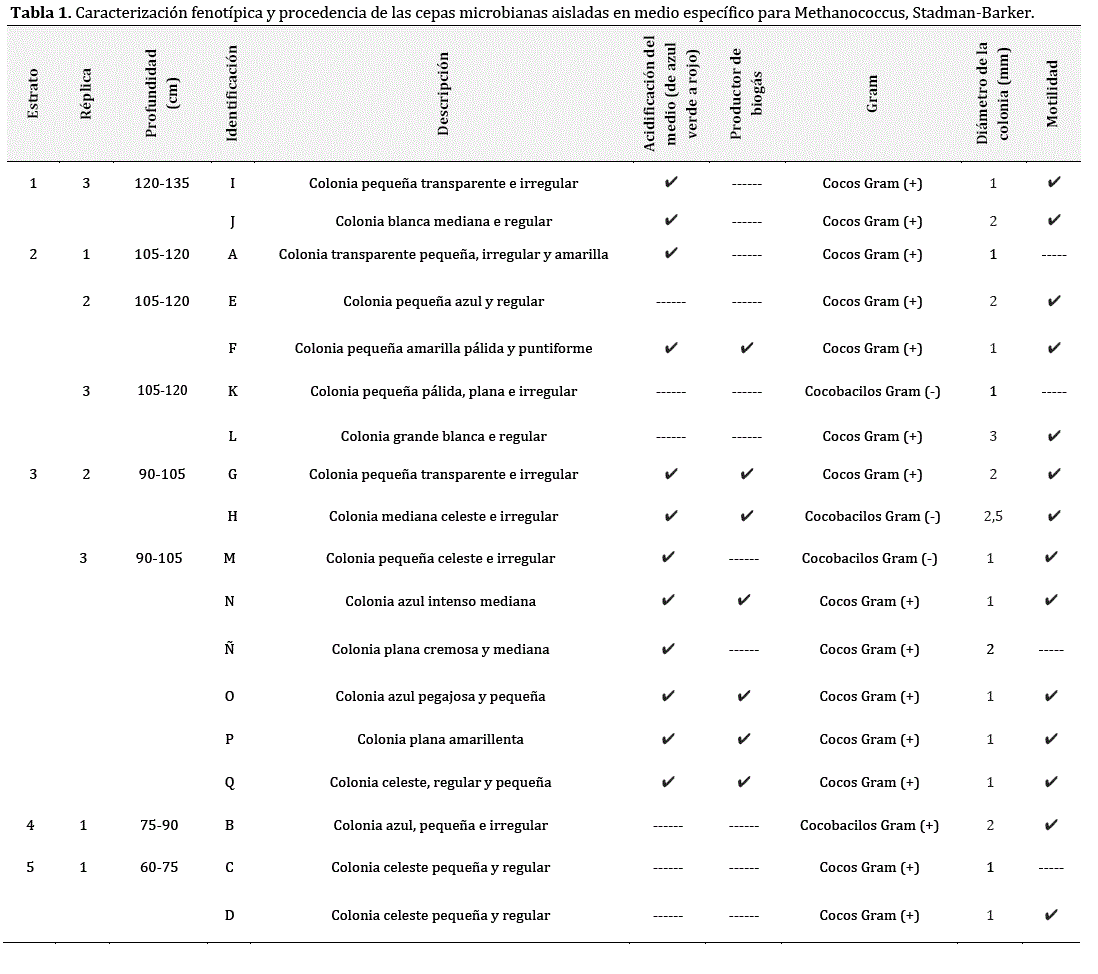
Un total de 36 cepas microbianas provenientes de los nueve estratos de fango residual analizados fueron aisladas en los medios de cultivo específicos para microorganismos metanogénicos (Tablas 1 y 2). Sin embargo, se registró producción de biogás exclusivamente en medio MC y solo en algunas de las cepas. No obstante, los consorcios intactos que generaron biogás lo hicieron tanto en medio MC como en medio MB. Por este motivo, los ensayos para evaluar la calidad del biogás producido se realizaron en medio MC, exclusivamente, para asegurar su producción tanto por cepas aisladas como por consorcios.
Dieciocho cepas microbianas cocoides (cocos y cocobacilos), en su mayoría Gram +, fueron aisladas en medio MC. Sus descripciones fenotipicas constan en la Tabla 1. Siete cepas produjeron biogás. Sin embargo, las características propias del género Methanococcus (27) se limitaron a las cepas identificadas como F y G, procedentes de los estratos entre 90 y 120 cm de profundidad de la cisterna colectora de desechos de camal. En cuanto a consorcios intactos, se detectó cualitativamente la producción de biogás sólo en los tres estratos más profundos, entre los 90 y los 135 cm (Tabla 2).
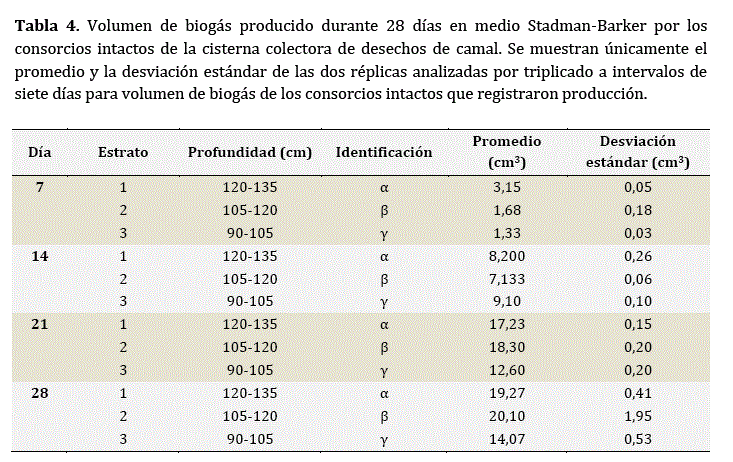
Los resultados cuantitativos de la producción de biogás por cepas aisladas y consorcios intactos corroboraron las observaciones anteriores. Estos resultados se resumen en las Tablas 3 y 4, respectivamente. Se registraron diferencias significativas en la producción de biogás a los 7, 10, 14, 21 y 28 días entre las cepas productoras de biogás (Fcepas7 = 464,105; Fcepas14 = 676,267; Fcepas21 = 3848,230; Fcepas28 = 5945,693; p < 0,01), con las cepas P, Q y N como las más eficientes en términos de cantidad de biogás producido a lo largo de los 28 días de seguimiento (Tabla 3).
Las cepas F, G y H mantuvieron perfiles de producción de biogás relativamente bajos o intermedios. Sin embargo, sólo las cepas Fy G resultaron productoras de metano (Tabla 5). Por su parte, los tres consorcios productores de biogás, aunque con diferencias en cuanto a cantidad de biogás producida entre los 7, 14, 21 y 28 días (Tabla 4; Fconsorcios7 = 1475,453; Fconsorcios14 = 15725,304; Fconsorcios21 = 22954,00; Fconsorcios28 = 8857,416; p < 0,01) fueron también productores de metano (Tabla 6).
En la tabla 5 Se muestran únicamente el promedio y la desviación estándar de las tres réplicas analizadas a intervalos de siete días para concentración de metano en el biogás de las cepas que registraron producción. Las cepas H, N, O, P y Q no produjeron metano a pesar de generar biogás.
En cuanto a la evolución de la generación de metano en las cepas F y G (Tabla 5), se observó que, tras siete días de incubación, la cepa G superó a F con 0,17 frente a 0,12 cm3 (t7 = 13,571; FCH4cepas7 = 3,010; p < 0,01). Transcurridos 14 días, la mayor producción de metano fue generada por la cepa F con 6,84 frente a los 2,44 cm3 de G (t14 = 116,031; FCH4 cepas14 = 3,237, p < 0,01). A los 21 días, F continuó superando a Gen producción de metano con 9,63 frente a 4,56 cm3 (t21 = 144,355; FCH4cepas21= 0,373; p < 0,01).
Finalmente, para el día 28, el porcentaje de metano producido por ambas cepas se igualó y superó al 87% (t28 = 2,115; FCH4cepas28 = 2,811; p > 0,05) con un total de 9,65 y 8,36 cm3 producidos por las cepas F y G, respectivamente. En cuanto a los consorcios (Tabla 6), el más eficiente en términos de pureza del biogás producido fue a, del estrato más profundo, durante todos los periodos analizados (FCH4consorcios7 = 29298,891; FCH4consorcios14 = 103950,640; FCH4consorcios21 = 21643,984; FCH4consorcios28 = 150944,487; p < 0,01), con un total de 90,17% de pureza de biogás o 17,38 cm3 de metano al final del periodo. Por tanto, para la confección de inóculos potenciadores de la producción de biogás de calidad se tomaron en consideración las cepas Fy G y el consorcio α.
En la tabla anterior se muestran únicamente el promedio y la desviación estándar de las dos réplicas analizadas por triplicado, a intervalos de siete días para volumen de biogás de los consorcios intactos que registraron producción.
Comparación de la cantidad y calidad de biogás producida por cepas aisladas y consorcios intactos mejores productores de metano individualmente y en inoculo combinado
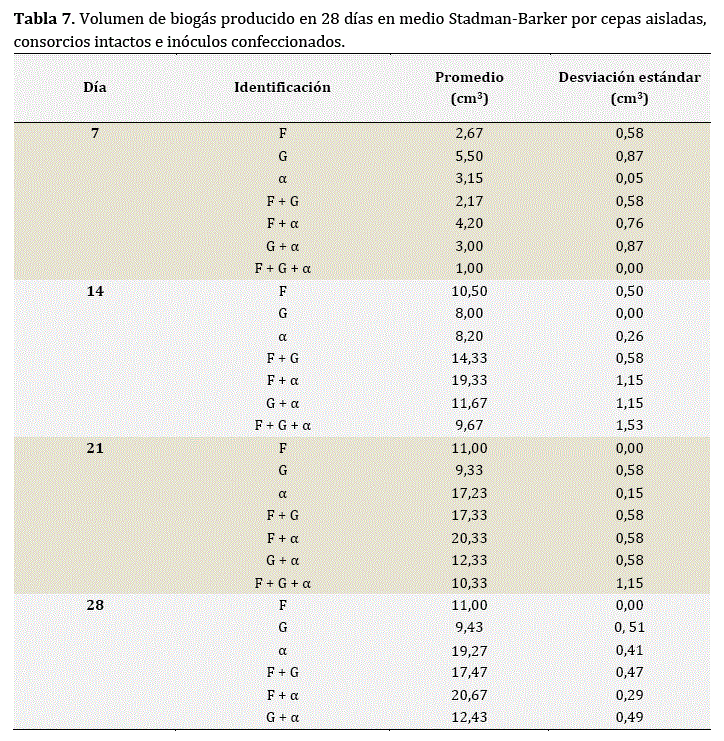
En la Tabla 7 y la Figura 2, se evidencia la producción progresiva de biogás a lo largo del tiempo tanto de cepas aisladas Fy G como del consorcio intacto a y los diferentes inóculos fabricados en base a las diferentes combinaciones posibles entre los tres primeros. Tras siete días de incubación, se obtuvieron volúmenes desde 1,00 hasta 5,50 cm3 (Finóculos7 = 720,281; p < 0,01). La mejor producción de biogás registró la cepa G, mientras que la más baja correspondió al consorcio más complejo (F + G + α). La producción de biogás de los inóculos conformados por una cepa bacteriana y el consorcio α tuvieron la misma productividad que el consorcio α individualmente. Por otro lado, la eficacia registrada por la cepa G individualmente se vio reducida cuando se encontró en consorcio (G + α, F + G y/o F+G + α).
Se muestran (tabla 7) datos numéricos del promedio de volumen de biogás producido, además de la desviación estándar respectiva para las tres réplicas de cepas e inoculos, y las dos réplicas analizadas por triplicado de los consorcios intactos.
Sin embargo, transcurridos 14 días, se produjeron entre 8,00 y 19,33 cm3 de biogás (Finóculos14 = 554,339; p < 0,01). Los inoculos confeccionados a partir de dos elementos, fueran estos cepa y consorcio o dos cepas, sobrepasaron la producción de biogás de las cepas y el consorcio intacto individualmente. El tratamiento más efectivo resultó el inoculo F+α, seguido del inoculo F + G y éste por G + α. Los tres elementos al origen de todas las combinaciones por separado y en consorcio complejo (F + G + α) obtuvieron la menor producción.
A los 21 días, se produjeron entre 9,33 y 20,33 cm3 (Finóculos21 = 1442,613; p < 0,01). El mejor productor de biogas siguió siendo F + α, seguido de F + G y éste por G + α, y tanto las cepas independientes F y G como el consorcio más complejo fueron los menos efectivos. No obstante, la producción de F + G fue equivalente a la de α y la de G + α a la de F.
Finalmente, para el día 28, entre 9,43 y 20,67 cm3 de biogas fueron producidos (Finóculos28 = 1792,888; p < 0,01). El mayor volumen de biogas correspondió nuevamente al consorcio F + α, seguido de F + G y éste por G + α. Sin embargo, la producción de F +αya no registró diferencias a la producción de α y, como a los 21 días, la producción de G + α no se diferenció de la de F. Las cepas individuales y el consorcio más complejo permanecieron como los menos efectivos.
En resumen, pese a registrarse variaciones a lo largo del periodo de 28 días, ni las diferentes combinaciones efectuadas ni las cepas individuales llegaron a sobrepasar la producción de biogas del consorcio intacto α. Las combinaciones de dos elementos resultaron efectivas solo puntualmente. El consorcio más complejo registró siempre la menor cantidad de biogas, la combinación G + α obtuvo valores intermedios, la combinación F+G osciló entre valores bajos y altos para terminar en valores intermedios, la cepa F mantuvo una producción intermedia baja y la cepa G pasó de la mejor a la menor producción en 28 días.
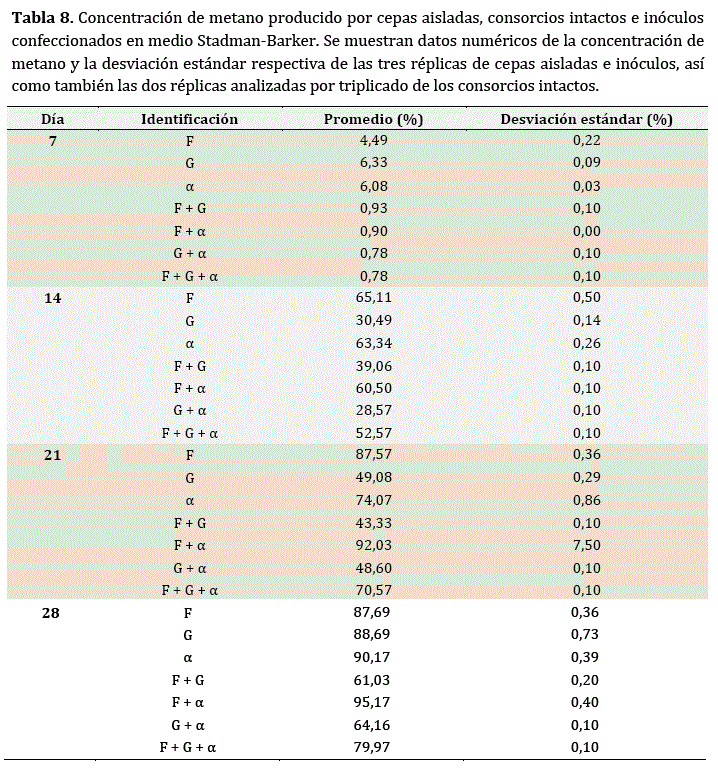
En la Figura 3 y la Tabla 8, se evidencia la evolución de la concentración de metano en el tiempo tanto de las cepas F y G como del consorcio intacto α y los diferentes inoculos confeccionados en base a las diferentes combinaciones posibles entre los tres primeros. A los siete días de incubación, se observaron porcentajes de metano desde 0,78 hasta 6,33% (FCH4inóculos7 = 4442,581; p < 0,01). La cepa G y el consorcio intacto a resultaron ser los más efectivos, seguidos por la cepa F. Por otro lado, todos los inoculos elaborados registraron la menor producción.
Transcurridos 14 días, se obtuvieron entre 28,57 y 65,11% de metano en el biogás producido (FCH4inóculos14 = 158754,593; p < 0,01). Todos los tratamientos analizados registraron porcentajes de metano distintos. La mejor calidad de biogás fue detectada en la cepa F, seguida por el consorcio α y éste por el consorcio F + α. El consorcio más complejo registró una productividad intermedia, mientras las tres combinaciones de dos o menos elementos que incluían a la cepa G resultaron las menos efectivas, con la acotación de que la cepa G fue mejor que la combinación G + α, pero menos eficaz que la combinación G + F.
A los 21 días de incubación, se alcanzó entre 43,33 y 92,03% de metano (FCH4inóculos21= 16426,062; p < 0,01). Nuevamente, todos los tratamientos salvo F + α y G + α resultaron diferentes en términos de porcentaje de metano en el biogás producido y el consorcio más complejo obtuvo una productividad intermedia. Destacó F + α como la composición más efectiva, seguida por la producción de metano de la cepa F y ésta por el consorcio intacto a. Por su parte, F+G tuvo la menor producción de metano.
Finalmente, para el día 28, se registró una pureza de metano en el biogás de entre 61,03 y 95,17% (FCH4inóculos28 = 122539,795; p < 0,01). Volvieron a registrarse diferencias altamente significativas entre los porcentajes de metano generados por todas las combinaciones evaluadas, salvo para las cepas individuales F y G, que evidenciaron una productividad intermedia. El inoculo F + α resultó ser el mejor, seguido por α y las cepas individuales. Las demás combinaciones no resultaron óptimas: el consorcio más complejo pasó a un cuarto lugar, mientras que las combinaciones G + α y F + α obtuvieron el quinto y sexto lugar, respectivamente, sin superar la producción individual de cepas y consorcio intacto involucrados.
En resumen, F + α demostró ser el inoculo confeccionado más efectivo desde el catorceavo día de incubación. Hasta los 14 días, su calidad de metano se vio superada por las cepas individuales y el consorcio α. Sin embargo, para el día 21 superó en cerca del 5% la calidad de la cepa más eficiente y en 18% al consorcio intacto más efectivo. El consorcio F+G resultó el menos efectivo, salvo a los 14 días. El consorcio G + α no destacó particularmente y el consorcio más complejo no superó valores intermedios.
DISCUSIÓN
Optimización de procesos de biodigestión mediante alteración del comportamiento metabólico de consorcios microbianos
La utilización del metano ha despertado el interés investigativo porque su aprovechamiento surge como alternativa de tratamiento para residuos sólidos acumulados (35). El enfoque principal abordado es su uso como un recurso energético renovable (36), más todavía si se considera que la materia prima constituyen los desechos.
En la parroquia de Pacto, incluida dentro de uno de los hotspots del territorio ecuatoriano (1,22), los desechos idóneos para el aprovechamiento energético del metano abundan, por lo que su tratamiento resulta fundamental para minimizar el impacto antropogénico y obtener energía renovable para los procesos productivos de su población. El aprovechamiento de estos desechos evita su acumulación y la contaminación ambiental y la potencial afectación a la salud humana derivadas. Para optar por esta alternativa en Pacto, se aislaron y caracterizaron cepas microbianas metanogénicas y consorcios productores de biogás y se analizó su calidad en términos de volumen de biogás y concentración de metano (13). Se dedujo que, al combinar a los generadores de metano más eficaces, la mejora en la cantidad y calidad del biogás obtenido permiten considerar el potencial del fango de camal para la generación de energía.
El incremento en el volumen de biogás y la proporción de metano en el mismo fue notable cuando se confeccionaron inóculos en base a la combinación de cepas aisladas efectivas con el consorcio mejor productor. Esto podría explicarse por el reforzamiento de relaciones de mutualismo simbiótico existentes entre especies metanogénicas y no metanogénicas. Es decir, que mientras más estrecha sea la sintrofía entre microorganismos metanogénicos hidrogenotróficos, acetoclásticos, metilotrópicos y otras bacterias con potencial sulfato-reductor, por ejemplo, mayor resulta la producción de biogás con concentraciones de metano altas (37,38). Las primeras se desarrollan con hidrógeno molecular como donador de electrones y CO2 como aceptor de electrones, aunque algunas usan formiato como fuente de CO2 y H2. Las especies acetoclásticas degradan acetato en grupos metilo y carbonilo hasta C02, permitiendo que el grupo metilo pase a metano (37,38).
Precisamente, este tipo de relaciones pudieron haberse reforzado en el inoculo que superó la concentración de metano del 90%, F + α. La particularidad de este inoculo es que la cepa aislada y el consorcio intacto utilizados provenían de estratos de fango residual diferentes. La sinergia obtenida podría deberse a que estaba disponible el nicho ecológico de la cepa aislada en el microhábitat ocupado por el consorcio (39,40). De hecho, combinar un conjunto de microorganismos genera una mayor cantidad de productos en los procesos biológicos, siempre y cuando sean compatibles (41,42). Esto implica la ausencia de competencia por sustrato que se traduce en mayor producción de metano (14).
Esto no ocurrió en la combinación G + α, aunque la cepa G provenía también de un estrato diferente al de α. La combinación se tradujo en pérdida de efectividad del consorcio originalmente establecido y cambio de su comportamiento metabólico por posible competencia por sustrato (37). Por otra parte, la combinación F + G resultó ser la menos efectiva, seguramente debido a los complejos requerimientos metabólicos y las particularidades fisiológicas que caracterizan a las cepas aisladas involucradas (37), lo que se traduce en antagonismo marcado. Es decir, la producción de metano de la combinación de las dos cepas resulta mucho menor que la de cada cepa individualmente. No obstante, obtiene valores de metano que resultan aprovechables como biocombustible.
García (42) detalla que cada estrato donde exista actividad metanogénica propia de un ambiente anaerobio en común, permite que las poblaciones microbianas coexistan. Además, se esperaría que mientras más microorganismos metanogénicos confluyan, el volumen de biogás y su concentración de metano aumenten (13,43). Sin embargo, el inoculo F + G + α distó mucho de ser el más eficiente en términos de volumen de metano. Al comparar dicha combinación con el resto de inóculos confeccionados, se observó que el inoculo G + α obtuvo valores incluso inferiores al inoculo más complejo, aunque superiores al inoculo F + G, resultando que los elementos implicados en los tres inóculos competirían entre sí por sustrato (43). No obstante, el inoculo F + G + α consigue mayor eficiencia que G + α, porque se habría complejizado el consorcio original al incluirse una cepa de nicho diferente (13,43).
Aplicabilidad energética del biogás producido por la generación de inóculos metanogénicos
Cepas aisladas o consorcios que generen biogás con un 70% de metano pueden ser considerados potenciales catalizadores de la optimización en procesos de biodigestión, puesto que, en el mejor de los casos, este valor es el máximo obtenido en la naturaleza (44). La mayoría de valores de pureza de biogás de este estudio superaron este umbral, incluyendo cepas aisladas, consorcios intactos e inóculos confeccionados. En este sentido, el biogás producido por estos tres tipos de catalizadores posibilitarían evadir el proceso de purificación de CO2, especialmente, haciéndolo directamente aprovechable para fines bioenergéticos (45).
Factores que podrían influenciar la producción de metano incluyen la relación H2/CO2, el formiato, el acetato, el metanol y las metil-aminas (12), conocidos como los mejores precursores en la metanogénesis.
Estos mismos compuestos son reducidos en la naturaleza, de manera que no resultan sustentables en la industria energética Factores que podrían influenciar la producción de que requiere de un mínimo de 45% de metano para ser considerado inflamable (46). En este estudio, el medio de cultivo MC, que contiene en su formulación el 82,8% de formiato de sodio, fue considerado el más idóneo para la obtención de microorganismos metanogénicos y resultó poseer un efectivo suministro de elementos que beneficiaron el desarrollo microbiano en forma líquida y sólida (27,37). Esto lo convierte en un oportuno catalizador directo de la metanogénesis, lo que explica la obtención de metano de parte de cepas aisladas y consorcios intactos en este medio. Sin embargo, sintetizar formiato de sodio o sus precursores en laboratorio o a escala industrial para procesos de biodigestión no resulta sustentable, a no ser que éste sea sintetizado biológicamente a partir de desechos orgánicos (37,47). Por esta razón, Ferrer (37) propone la elección de inoculantes metanogénicos para el mejoramiento de la calidad y el rendimiento del biogás; precisamente, lo que ha conseguido esta investigación.
Un volumen de biogás con concentraciones superiores o iguales al 45% de metano es inflamable y, por ende, aprovechable. Por otro lado, altos porcentajes de metano en el biogás (70% o más) incrementan su poder calorífico (12,48). Esto justifica el planteamiento de potenciar la producción de metano a partir de la formulación de inoculantes microbianos metanogénicos eficaces (46). En efecto, los resultados obtenidos demuestran la potencialidad de la optimizacion del proceso de biodigestión para proveer de energía renovable. Se ha conseguido elevar la concentración de metano del 90 al 95%. Es decir, que en la cisterna colectora de desechos de camal de 12 x 2 x 1,35 m solo el último estrato, perteneciente al consorcio α, y tomando en cuenta que cada estrato era de 15 cm de espesor, al tomar 1 cm3 de éste se producirían 48,7 m3 de metano en 28 días, tomando como base una producción mínima de 15 cm3 de biogás y 13,5 cm3 de metano por cada cm3 de biomasa. Si a esto se sumaran los 6,3 m3 producidos por el segundo estrato, correspondiente al consorcio β (producción mínima de 10 cm3 de biogás y 1,2 cm3 de metano por cada cm3 de biomasa), y 0,9 m3 del tercer estrato (producción mínima de 5 cm3 de biogás y 0,25 cm3 de metano por cada cm3 de biomasa), se obtendría un volumen total de metano de 56 m3 dentro de la cisterna.
Sin embargo, si se combinara el consorcio intacto α del último estrato con la cepa F proveniente del segundo estrato, el valor resultante de dicha combinación sería 68 m3 y se obtendría una producción total de 124 m3 de metano (producción mínima de 20 cm3 de biogás y 19 cm3 de metano por cada cm3 de biomasa). En base a estas estimaciones conservadoras y estudios que demuestran que a partir de 31,9 m3 de biogás al 77,9% de metano se obtienen 274 kWh (49), en este estudio se calcula que mediante la composición de inoculos metanogénicos eficaces se podrían obtener en 28 días 1364,8 kWh de energía eléctrica para consumo.
En 2016, un estudio realizado por Baquero en la ciudad de Cuenca, Ecuador (50) evidenció que mensualmente, por domicilio, se consumían en promedio 201,40 kWh. Con base en este consumo eléctrico, la producción de metano de la cisterna de Pacto podría abastecer una casa durante seis meses, aproximadamente, siempre y cuando las condiciones se asemejen al medio MC, lo que resulta poco probable por lo antes expuesto. Adicionalmente, debe tomarse en cuenta el comportamiento microbiano a gran escala para determinar si, en realidad, los volúmenes de metano estimados en este estudio lograrían ser obtenidos en la práctica, pues la Secretaria de Medio Ambiente y Recursos Naturales de Ecuador (51) menciona que los volúmenes grandes de desechos orgánicos deben ser estables y bien seleccionados para que generen biogás de calidad energética sustentable.
Aun así, el Plan Maestro de Electrificación elaborado por el Consejo Nacional de Electricidad de Ecuador en 2013 (52), determinó que para el año 2017, el promedio de consumo residencial en la ciudad de Quito sería de 152 kWh mes-1 sin uso de cocina a inducción y, con uso de ésta, habría un consumo adicional de 100 kWh mes-1. Es decir, mensualmente se consumirían 252 kWh, aproximadamente. En este sentido, si una casa usa cocina a inducción podría ser abastecida de energía eléctrica generada por biogás durante cinco meses, siempre y cuando la casa, el edificio, la tienda o cualquiera que desee adoptar un sistema de generación de energía renovable que funcione de forma eficiente a base de biogás, cuente con inoculantes metanogénicos y desechos orgánicos idóneos (37). Adicionalmente, es indispensable un biodigestor diseñado técnicamente que cuente con todas las seguridades para evitar posibles accidentes, esté en buen estado y posea la maquinaria necesaria para transformar el biogás en energía (49,51). El manejo riguroso y el empleo de las mejores alternativas económicas en cuanto a la adquisición de insumos como el formiato de sodio como principal precursor de metanogénesis identificado en este estudio, por ejemplo, harán que el biogás pueda ser usado de forma exitosa y se convierta en la alternativa de gestión de desechos orgánicos propuesta en esta investigación. Se trata de una tecnología accesible, de bajo costo y muy prometedora para comunidades rurales que requieren mejorar el manejo de sus desechos.
CONCLUSIONES
Combinar un conjunto de microorganismos metanogénicos posibilita un aumento significativo en la cantidad y la calidad de los productos del proceso de biodigestión siempre que sean compatibles. La manipulación de la dominancia de una determinada especie de un consorcio, no se traduce necesariamente en el aumento de la productividad metabólica del conjunto. La combinación de dos cepas metanogénicas aisladas puede resultar en antagonismo marcado. El sustrato que permitió evidenciar la optimización de los procesos de biodigestión fue el medio de cultivo MC que constituyó un catalizador directo de la metanogénesis. La optimización en la producción de metano se debe a la formación de inóculos seleccionados de microorganismos metanogénicos eficaces.
Esta investigación ha conseguido generar un inoculante microbiano capaz de catalizar la metanogénesis, de manera que se potencien los volúmenes de biogás aprovechable como biocombustible.
REFERENCIAS BIBLIOGRÁFICAS
1. Gestnova. Plan de Desarrollo y Ordenamiento Territorial de la Parroquia de Pacto [Internet], lst ed. Gestnova, editor. Quito: SNI; 2015;143 Available from: http://app.sni.gob.ee/sni-link/sni/PORTAL_SNI/data_sigad_plus/si gadplusdocumento final/1768128260001 _GESTNOVA_PDyOT_PACTOFINAL_30-10-2015_20-27-52.pdf [ Links ]
2. Agrocalidad. Resolución y Manual de Mataderos_Agrocalidad [Internet]. Quito; 2013. Avaüable from: http://web.agrocalidad.gob.ee/documentos/RESOLUCIONES-Y-MANUAL-DE-MATADEROS.pdf [ Links ]
3. Massa D. La centralidad rural de la microregión del noroccidente del Distrito Metropolitano de Quito: Modelos de desarrollo, procesos e influencias en las dinámicas socialesy económmicas territoriales. Caso Parroquia de Gualea [Internet]. Flacso Andes; 2014. Avaüable from: https://repositorio.flacsoandes.edu.ec/handle/10469/7591 [ Links ]
4. Gadp. Plan de desarrollo y ordenamiento territorial de la parroquia pacto [Internet]. Quito; 2012. Avaüable from: http://sitp.pichincha.gob.ee/repositorio/diseno_paginas/archivos/PDOTPACTO 2012.pdf [ Links ]
5. Martí-Herrero J. Biodigestores familiares: Guía de diseño y manual de instalación ( 2008 ) [Internet]. Programa d. La Paz: Cooperación Ténica Alemana; 2015; 86 Avaüable from: https://www.researchgate.net/publicati on/282156621l_Biodigestores_famüiares _Guia_de_diseno_y_manual_de_instalacion_2008 [ Links ]
6. Gutiérrez S. Estudio de parámetros de combustión en quemadores atmosféricos de glp para elaborar maní garapiñado en la fábrica piedad de la ciudad de ambato y su incidencia en el consumo energético. [Internet]. Universidad Técnica de Ambato; 2015. Avaüable from: https://repositorio.uta.edu.ec/bitstream/123456789/10576/1/TesisI.M. 277 -Gutiérrez Altamirano Santiago Javier.pdf [ Links ]
7. Martina P, Yank L, Corace J, Bucki Wasserman B, Aeberhard R, Ventín A. Estudio de la producción de biogas en función de la cantidad de residuos de madera en un biodigestor del tipo de carga única o batch. ASADES [Internet]. 2005; (9):23-7. Avaüable from: https://core.ac.uk/download/pdf/301096225.pdf [ Links ]
8. García Fabio. Manual de Estadísticas Energéticas [Internet]. OLADE. García Fabio, editor. Quito: Biblioteca OLADE; 2011;191. Avaüable from: http://biblioteca.olade.org/opac-tmpl/Documentos/oldo179.pdf [ Links ]
9. Kallio P, Pásztor A, Thiel K, Kalim M, Jones PR. An engineered pathway for the biosynthesis of renewable propane. Nature [Internet]. 2014;4-ll. Avaüable from:https://www.ncbi.nlm.nih.gov/pmc/artic les/PMC4164768/pdf/ncomms5731.pdf
10. Zhang L, Liang Y, Wu W, Tan X, Lu X. Biotechnology for Biofuels Microbial synthesis of propane by engineering valine pathway and aldehyde deformylating oxygenase. Biotechnol Biofuels [Internet]. BioMed Central; 2016;(9):l-9. Avaüable from: https://biotechnologyforbiofuels.biomedcentral.com/articles/10.1186/sl3068-016-0496-z
11. Schlüter A, Bekel T, Diaz NN, Dondrup M, Eichenlaub R, Gartemann K, et al. The metagenome of a biogas-producing microbial community of a production-scale biogas plant fermenter analysed by the 454-pyrosequencing technology. ELSEVIER [Internet]. 2008;(136):77-90. Avaüable from: https://www.sciencedirect.com/science/article/abs/pii/S0168165608001983?vi a%3Dihub [ Links ]
12. López F, Lahoz A, Cuadros F, González J, Zamora J, Hewit A, et al. Aprovechamiento Energético del Residuo Ganadero [Internet]. Agencia Ex. Agencia Extremeña de la Energía., editor. Badajoz: Agencia Extremeña de la Energía; 2014; 235 p. Avaüable from: http://www.agenex.net/guias-altercexa/4_APR0VECHAMIENT0_DEL_RESIDUO_GANADERO.pdf [ Links ]
13. Domínguez MG. Caracterización fermentativa de biodigestores de cerdaza y aislamiento de una arqueobacteria metanogénica [Internet]. Colegio de Postgrduados - Institución de Enseñanza e Inwestigación en Ciencias Agrícolas; 2014. Avaüable from: http://www.lareferencia.info/vufind/Record/MX_clfd2f7a775fba2f7d41b3cef7468cb3 [ Links ]
14. Yang Z, Guo R, Xu X, Wang L, Dai M. Bioresource Technology Enhanced methane production via repeated batch bioaugmentation pattern of enriched microbial consortia. Bioresour Technol [Internet]. Elsevier Ltd; 2016;(216):471-7. Avaüable from: http://dx.doi.Org/10.1016/j.biortech.2016.05.062 [ Links ]
15. Corrales L, Antolinez D, Bohórquez J, Corredor A. Bacterias anaerobias: procesos que realizan y contribuyen a la sostenibilidad de la vida en el planeta. NOVA [Internet]. 2015;13(23):55-81. Avaüable from: http://www.scielo.org.co/pdf/nova/v13n24/v13n24aO6.pdf [ Links ]
16. Stantscheff R, Kuever J, Rabenstein A, Seyfarth K, Dróge S, Kónig H. Isolation and differentiation of methanogenic Archaea from mesophüic corn-fed on-farm biogas plants with special emphasis on the genus Methanobacterium. Appl Microbiol Bio technol [Internet]. 2014;98:5719-35. Avaüable from: https://link.springer.com/content/pdf/10.1007/s00253-014-5652-4.pdf [ Links ]
17. Garzón P, Ochoa-herrera V, Peñafiel R. Estudio de la generación de gas metano a partir del agua residual del proceso de extracción de aceite crudo de palma en biodigestores experimentales. Av en Ciencias e Ing [Internet]. 2015;7(2):8. Avaüable from: https://revistas.usfq.edu.ec/index.php/avances/article/view/274/275 [ Links ]
18. Ito T, Yoshiguchi K, Dwi H, Okabe S. Bioresource Technology Identification and quantification of key microbial trophic groups of methanogenic glucose degradation in an anaerobic digester sludge. Bioresour Technol [Internet]. Elsevier Ltd; 2012;123:599-607. Avaüable from: http://dx.doi.Org/10.1016/j.biortech.2012.07.108 [ Links ]
19. Pagés J, Pereda I, Lundin M, Sárvári I. Bioresource Technology Co-digestion of different waste mixtures from agro-industrial activities: Kinetic evaluation and synergetic effects. ELSEVIER [Internet]. 2011;102:10834-40. Avaüable from: https://www.sciencedirect.com/science/article/abs/pii/S0960852411013009?via%3Dihub [ Links ]
20. Bah CSF, Bekhit AEA, Carne A, Mcconnell MA. Slaughterhouse Blood : An Emerging Source of Bioactive Compounds. Compr Rev [Internet]. 2013;12:314-31. Avaüable from: https://onlinelibrary.wiley.com/doi/full/10.1111/1541-4337.12013 [ Links ]
21. Torres P, Pérez A. Actividad metanogénica específica: una herramienta de control y optimización de sistemas de tratamiento anaerobio de aguas residuales. Redalyc [Internet]. 2010;(9):5-14. Avaüable from: https://www.redalyc.org/pdf/2311/231116434001.pdf [ Links ]
22. RiABM. Reunión del Directorio de la RIABM 13 [Internet]. Lima; 2017. Avaüable from: http://www.bosquesmodelo.net/reunion-del-directorio-de-la-riabm/ [ Links ]
23. Balarezo D, Escobar Z, Peralvo M, Galmez V. B0LETiN-MCA-2.pdf [Internet]. Nanegal; 2016. Avaüable from: http://www.bosquesandinos.org/wp-content/uploads/2017/01/BOLETÍN-MCA-2.pdf [ Links ]
24. Chamarro I. Controles de calidad y valores de referencia para datos de oceanografía química. El caso del Radial Profundo de Canarias. Universidad Politécnica de Valencia; 2015. [ Links ]
25. Méndez C, Mesa V, Sprenger R, Richter M, Suárez M, Solano J, et al. Microbial stratification in low pH oxic and suboxic macroscopic growths along an acid mine drainage. ISME [Internet]. 2014;(8):1259-74. Avaüable from: https://www.nature.com/articles/ismej 2013242.pdf [ Links ]
26. Moreno J, Albarracín V. Aislamiento , cultivo e identificación de microorganismos ambientales a partir de muestras naturales. Reducá Biol [Internet]. 2012;5(5):79-93. Available from:http://www.revistareduca.es/index.php/biologia/article/viewFüe/963/996 [ Links ]
27. Acuña P, Ángel L, Montoya E, Corrales L, Sánchez L. Aislamiento e identificación de microorganismos del género Methanococcus y Methanobacterium de cuatro fuentes de Bogotá D . C . NOVA [Internet]. 2008;6(10):101-236. Available from: https://hemeroteca.unad.edu.co/index.php/nova/article/view/406 [ Links ]
28. Elizarrás P, Serafín A, Magaña P. Caracterización microbiológica de agentes metanogénicos sobre productores de biometano en condiciones mesofílicas para lodos de tenerías. Jóvenes en la Cieñe [Internet]. 2015;2(l):1963-7. Available from: http://www.jovenesenlaciencia.ugto.mx/index.php/jovenesenlaciencia/article/view/438/pdf
29. Posada SL, Noguera R, Bolívar D. Relación entre presión y volumen para la implementación de la técnica in vitro de producción de gases en Medellín , Colombia. Rev Colomb Ciencias Pecu [Internet]. 2006;19(4):407-14. Available from: rccpecuarias@rccp.udea.edu.co [ Links ]
30. Edith F. Hidroxiapatitas Ca-Zn: Un Nuevo Soporte en la Reacción de Hidrodesulfuración de Tiofeno [Internet]. Universidad de Carabobo; 2016. Available from: http://hdl.handle.net/123456789/4107 [ Links ]
31. Mnif I, Mnif S, Sahnoun R, Maktouf S, Ayedi Y, Ellouze S, et al. Biodegradation of diesel oü by a novel microbial consortium: comparison between co-inoculation with biosurfactant-producing strain and exogenously added biosurfactants. Environ Sci Pollut Res [Internet]. 2015;(22):14852-61. Available from: https://link.springer.com/article/10.1007/sll356-015-4488-5 [ Links ]
32. Hays SG, Patrick WG, Ziesack M, Oxman N, Silver PA. ScienceDirect Better together : engineering and application of microbial symbioses. Curr Opin Biotechnol [Internet]. Elsevier Ltd; 2015;(36):40-9. Available from: http://dx.doi.Org/10.1016/j.copbio.2015.08.008 [ Links ]
33. García R, González J, Jornet J. S P S S: PRUEBA T [Internet]. Valencia: InnovaMIDE; 2010. Available from: https://www.uv.es/innomide/spss/SPSS/SPSS_0701b.pdf [ Links ]
34. Hurtado M, Berlanga V. Cómo aplicar las pruebas paramétricas bivariadas t de Student y AN0VA en SPSS . Caso práctico. REIRÉ [Internet]. 2012;5(2):83-100. Available from: www.ub.edu/ice/reire.htm [ Links ]
35. Camargo Y, Vélez A. Emisiones de biogas producidas en rellenos sanitarios. In: Camargo Y, Vélez A, editors. II Simposio Iberoamericano de Ingeniería de Residuos [Internet]. Barranquilla: Red de Ingeniería en Saneamiento Ambiental; 2009. p.13. Available from: https://www.researchgate.net/publicati on/276062721_EMISIONES_DE_BIOGAS_ PRODUCIDAS_EN_RELLENOS_SANITARIOS [ Links ]
36. Barragán E, Arias PD, Terrados J. Fomento del metabolismo energético circular mediante generación eléctrica proveniente de rellenos sanitarios: Estudio de caso , Cuenca , Ecuador. INGENIUS [Internet]. 2016;(16):36-42. Available from: https://revistas.ups.edu.ec/index.php/ingenius/article/view/16.2016.05 [ Links ]
37. Ferrer Y, Pérez H. Los microorganismos en la digestión anaerobia y la producción de biogás. Consideraciones en la elección del inoculo para el mejoramiento de la calidad y el rendimiento. ICIDCA [Internet]. 2010;43(l):l-13. Available from: http://www.redalyc.org/articulo.oa?id=223120681002
38. Salazar K. Estructura poblacional de bacterias sulfato reductoras y arqueas metanógenas en perfiles sedimentarios de lagunas de aguas blancas y aguas negras de la cuenca amazónica del río Beni [Internet]. Universidad Mayor de San Andrés; 2008. Available from: https://horizon.documentation.ird.fr/exl -doc/pleins_textes/diversl6-09/010045028.pdf [ Links ]
39. Icaza M. Microbiota intestinal en la salud y la enfermedad. Rev Gastroenterol México [Internet]. Asociación Mexicana de Gastroenterología; 2013;78(4):240-8. Available from: http://dx.doi.Org/10.1016/j.rgmx.2013.04.004 [ Links ]
40. Otero P. Cari Woese y los dominios de la vida. Rev Boletín biológica [Internet]. 2017;37(ll):27-33. Available from: https://dlwqtxtslxzle7.cloudfrontnet/61 544452/historia3720191217-16462-w2madb.pdf?1576628674=&response-content-disposition=inline%3B+filename%3DHISTORIA_DE_LA_BIOLOGIA_Carl_WoesejMos.pdf&Expires=1600299679&Signature=MydZI2K07rvLhIy
RAafCB8TkantNZc8peYw0 BdlCF7NOoNQeMUV6DuiFqzgIUf3igrOC2mSgWZawlv4fxOTsGdld07s~rVxgoK-5Gd~5an5Y7X~ofORHyyMR4~ETlTFEhb~Wol-vAPo0zolRVoYDhPJyLAOM40P8-qfGb~C~ix00Q
InUvSFbh6ixc75hCJQPDah8LuhsKp-uhmWUbuBoIekjlbd4fqEdErC9fHhfNWHMRuOFnXH~x-oPjEKYxyQmQgDeYwI-oj~U4Uilr37uhDZKdLlPgqoJg4C02Qhfs7Vs3ktaHleSM8Q9HBk86VMH0sWPZ8mv6kh FCX3zt92w_&Key-Pair-Id=APKAJLOHF5GGSLRBV4ZA
41. Quintero L. Tecnologías para la decoloración de tintes índigo e índigo Carmín. ResearchGate [Internet]. 2010;162(77):371-86. Available from: https://www.researchgate.net/publicati on/49598648_TECNOLOGIAS_PARA_LA_ DECOLORACION_DE_TINTES_INDIGO_E_I NDIGO_CARMIN [ Links ]
42. García J. Producción de metano en ambientes hipersalinos: Diversidad microbiana, estructura y función de la comunidad de arqueas metanógenas [Internet]. Centro de Investigaciones Biológicas del Noroeste, S. C; 2014. Available from: http://dspace.cibnor.mx:8080/handle/123456789/279 [ Links ]
43. Gallegos M, Celis L, Razo E. Competencia por sustrato durante el desarrollo de biomasa sulfatorreductora a partir de un lodo metanogénico en un reactor uasb Marisol. Contam Ambient [Internet]. 2010;26(2):109-17. Available from: http://www.scielo.org.mx/pdf/rica/v26n2/v26n2a2.pdf [ Links ]
44. Rodríguez L. Viabilidad técnica para producción de biogás a partir de la fracción orgánica de los residuos sólidos urbanos [Internet]. Universidad EAN; 2014. Available from: https://repository.ean.edu.co/bitstream /handle/10882/1560/RodriguezLuis201 4.pdf;jsessionid=5B2C341DFAD05C4BDE 0D0FD3BCC30481?sequence=1 [ Links ]
45. Molina I, Cantet J, Montoya S, Correa G, Barahona R. In vitro methane production from two tropical grasses alone or in combination with Leucaena leucocephala or Gliricidia sepium. CES Med Vet y Zootec [Internet]. 2013;8(2):15-31. Available from: http://www.scielo.org.co/scielo.php7script=sci_arttext&pid=S1900-96072013000200002 [ Links ]
46. Deublein D, Steinhauser A. Biogas from Waste and Renewable Resources [Internet]. Deublein D, Steinhauser A, editors. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA,; 2008. p.443 Available from: https://books.google.com.ec/books?hl=es&lr=&id=CJiMmmxu2tcC&oi=fnd&pg=PT13&dq=Biogas+from+Waste+and+Renewable+Resources&ots=ImhtgRePLd&sig=05N0sfbOen6OUt7
kIqsEeHaAYjQ#v=on epage&q=Biogas from Waste and Renewable Resources&f=false
47. Diego M. Universidad de salamanca [Internet]. Universidad de Salamanca; 2015. Available from: https://www.europeana.eu/en/item/2022712/lod_oai_gredos_usal_es_103 66_127809entO [ Links ]
48. Magaña Ramírez JL, Rubio Núñez R, Jiménez Islas H, Martínez García MT. Tratamiento anaerobio de dése- chos lácticos y estiércol de cabra Anaerobic treatment of lactic waste and goat manure. Ing e Investig [Internet]. 2011;31(l):93-8. Available from: http://www.redalyc.org/articulo.oa?id=64321170011%0ACómo
49. Quesada R, Salas N, Arguedas M, Botero R. Generación de energía eléctrica a partir de biogás. Tierra Trop [Internet]. 2007;3(2):227-35. Available from: https://www.academia.edu/19201597/GENERACIÓN_DE_ENERGÍA_ELÉCTRICA_ A_PARTIR_DE_BIOGÁS [ Links ]
50. Baquero M, Quesada F. Eficiencia energética en el sector residencial de la Ciudad de Cuenca, Ecuador. 2016;7(2):147-65. [ Links ]
51. SEMARNAT. Especificaciones Técnicas para el Diseño y Construcción de Biodigestores en México [Internet]. México; 2010. Available from: http://biblioteca.semarnat.gob.mx/janiu m/Documentos/Ciga/libros2009/CD001057.pdf [ Links ]
52. CONELEC. PLAN MAESTRO DE ELECTRIFICACIÓN. In: CONELEC, editor. Plan Maestro de Electrificación [Internet]. 2nd ed. Quito: Ministerio de Electricidad y Energía Renovable; 2013. p. 206. Available from: https://www.regulacionelectrica.gob.ec/wp-content/uploads/downloads/2015/12/Vol2-Estudio-y-gestión-de-la-demanda-eléctrica.pdf [ Links ]