INTRODUCCIÓN
La toxicidad de los elementos en los suelos, no se limita a la concentración total, sino también a los mecanismos de distribución y la capacidad de reacción con otros componentes de un ecosistema1. La contaminación por arsénico (As) en agua de consumo es a menudo debido a la meteorización de minerales de rocas y suelos2 transferidos a la fase acuosa. Este metaloide puede encontrarse en el suelo como arsenopirita (FeAsS) y otros minerales de arseniato3. La determinación de “As total" en muestras biológicas y ambientales es un primer paso importante en el trabajo analítico que conduce a la identificación y cuantificación de compuestos de As4. En los métodos de análisis por espectrofotometría de Absorción Atómica (AAS, sigla en inglés), el análisis de As en suelos se realiza en matriz liquida, por lo que es necesario realizar una digestión ácida. Es recomendable digerir las muestras con ácidos oxidantes para convertir todos los compuestos de arsénico en arseniatos4).; el método ampliamente utilizado es la digestión con agua regia denominado Análisis Pseudo Total (APT). Esta extracción no destruye en su totalidad a las muestras sólidas siendo necesario el uso de ácido fluorhídrico (HF) para disolver las estructuras de silicato5. No obstante, el uso de HF exige tener condiciones especiales, tanto en materiales como de laboratorio.
La limitada información de los estudios de la existencia de arsénico geogénico en el altiplano boliviano6 reporta altas concentraciones de As en las muestras de agua potable recolectadas en un área no afectada por la minería, ubicada en el sur y oeste del lago Poopó7),(8.
El As es el contaminante más importante en los suelos agrícolas siendo las fuentes geogénicas más generalizadas que las fuentes antropogénicas9. Es importante determinar los niveles de As debido a que el exceso de este elemento en el suelo puede alterar el metabolismo de las plantas y disminuir la productividad de los cultivos, ejerciendo presión en última instancia en las tierras de labranza10.
El presente trabajo pretende fortalecer la determinación de As en muestras de suelos agrícolas, mediante el APT llevado a cabo por High Resolution Continuum System Graphite Furnace Atomic Absorption Spectrophotometry (HR-CS-GFAAS). La volatilidad relativa de la matriz y del analito puede ser controlada por la adición de modificadores de matriz a la muestra que contiene el analito, con el propósito de hacerlo menos volátil. De esta forma, permite el uso de temperaturas de calcinación más altas para promover la remoción de la matriz.
EXPERIMENTAL
Instrumentación
Las medidas se llevaron a cabo en un Espectrómetro de Absorción Atómica técnica Horno de Grafito, marca Analytik Jena modelo ContrAA800, equipado con una lámpara de arco corto de Xe de alta intensidad como fuente continua (HR-CS-GFAAS). El equipo cuenta con un monocromador doble de alta resolución y un detector de dispositivo de carga acoplada (CCD). En el software Aspect CS versión 2.3.0.0, se seleccionó el elemento As y la línea 193.696 nm como longitud de onda. Para la preparación de muestras, se utilizó una balanza Metler Toledo (± 0,0001g). La digestión ácida de muestras de suelos se realizó utilizando un sistema de digestión cerrada en un Horno de Microondas Anton Paar modelo Microwave 3000.
Reactivos, soluciones y muestras
En la preparación de las soluciones del estándar y del modificador, se utilizó ácido nítrico al 0.2%, preparados a partir del ácido nítrico destilado, para asegurar la pureza del ácido, y aforado con agua desionizada con una resistividad de 18.2 MΩ-cm. Se utilizó una solución estándar de As de 1000 ppm (marca Perkin Elmer). A partir de esta solución se preparó una solución de 50 µg/L para la curva de calibración. Las soluciones se prepararon en material volumétrico tipo A. Para el lavado de los materiales de vidrio, se dejaron en remojo en ácido nítrico al 10% por al menos 24 horas. Se enjuagó tres veces con agua destilada y tres veces con agua desionizada.
En la preparación del modificador de nitrato de paladio (Pd/Mg(NO3)2) para el análisis del As, se tomó 1 mL de alícuota de solución de modificador (marca Perkin Elmer) de Pd(NO3)2 al 1% y se llevó a un matraz aforado de 10 mL. Por otra parte, se tomaron 0.5 mL de alícuota de solución de modificador de nitrato de magnesio (Mg(NO3)2) al 1% y se llevaron al mismo matraz aforado y se llevó a volumen de aforo con una solución de ácido diluido de HNO3 al 0.2%.
Para la optimización del método en HR-CS-GFAAS mediante el diseño experimental, se llevó a cabo una digestión ácida del material de referencia interno (MRI) en el laboratorio de Hidroquímica de la Universidad Mayor de San Andrés (UMSA) y fue validado por el laboratorio de HydroSciences de la Universidad de Montpellier en Francia.
Para los ensayos de validación del método optimizado, se prepararon soluciones patrón por pesada a partir del material de referencia WWS2 con 500 µg/L de As. Se aforaron soluciones estándar de 10 mL con ácido nítrico destilado al 0.2% resultando en soluciones patrón con concentraciones de 0.00; 4.725; 14.205; 29.315 y 49.055 µg/L de As.
Digestión de la muestra
Para la digestión ácida en sistema cerrado se utilizó el equipo de microondas Multiwave Anton Paar 3000. Se pesó 0.25 g de una muestra compuesta de suelos agrícolas y se llevó al vaso de digestión de cuarzo. Se agregó 1.5 mL de HCl y 3.5 mL de HNO3 ambos destilados. La menor proporción de HCl es para evitar la volatilización de tricloruro de arsénico4. La muestra preparada se llevó a una campana de flujo laminar para una predigestión por 24 h. Para armar los vasos de digestión con las válvulas se verificó que la muestra no desprenda burbujas. Para iniciar la digestión, los vasos se llevaron al rotor de digestión, luego se ajustó las muestras mediante presión de las manivelas del rotor11. El programa de digestión con microondas se realizó en un tiempo total de 55 min y un aumento secuencial de potencia de 0 a 300 W; de 300 a 500 W y 500 a 700 W, la temperatura y presión interna dependen de la potencia de irradiación.
Se realizaron las digestiones de las muestras por duplicado para un control de calidad. Para la preparación de las soluciones de las digestiones las soluciones ácidas de los vasos de digestión se trasvasaron mediante embudos a matraces aforados de 25 mL y se llevaron a volumen de aforo con agua desionizada.
Diseño experimental del método de análisis de arsénico por HR-CS-GFAAS
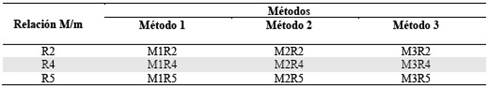
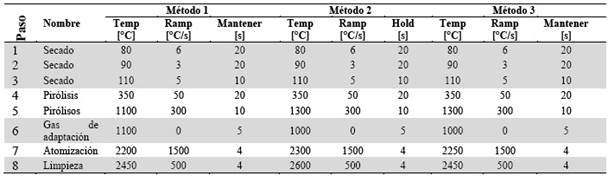
Para obtener la mayor sensibilidad instrumental posible para la determinación de As se realizó la optimización del método. Se utilizaron soluciones de digestión ácida de una muestra compuesta de suelo agrícola como material de referencia interno dentro de laboratorio. El diseño experimental se realizó mediante el Modelo de Superficies de Respuesta (MSR) de dos factores en tres niveles. Los factores son los Métodos de análisis (Tabla 1) que describen temperaturas de pirólisis y de atomización característicos a cada método.
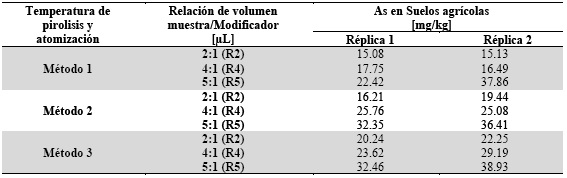
El Método 1, es descrito por el método del software ASpect CS versión 2.3.0.0 del Analytik Jena ContrAA800 con temperatura de pirólisis y atomización de 1100 y 2200°C, respectivamente12. El Método 2 tiene temperaturas de pirólisis y de atomización utilizadas en el instrumento Espectrómetro Perkin Elmer Analyst 100 del laboratorio de Hidroquímica de la Universidad Mayor de San Andrés (UMSA). Las temperaturas del método 2 son 1300 y 2300°C13),(14. Finalmente, el Método 3 describe temperatura de pirólisis y atomización de 1300 y 2250°C, respectivamente. Estas temperaturas se consiguieron a partir de optimizaciones de muestras de soluciones de digestiones de suelos mediante microondas, que se realizaron instrumentalmente15 por HR-CS-GFAAS. El otro factor son las tres relaciones de volumen entre muestra y modificador en µL (Tabla 2). El diseño experimental aplicado a la adquisición de resultados, se puede observar en la Tabla 3.
Tabla 1 Comparación de temperatura de secado, pirólisis, atomización y limpieza de los tres métodos de determinación de As
Softwares de análisis de absorción atómica y evaluación estadística
El instrumento Analytik Jena ContrAA800 utiliza el software ASpect CS versión 2.3.0.0 para el control del AAS. Para el tratamiento estadístico de los datos se utilizaron los programas estadísticos Minitab versión 17.0 e IBM SPSS versión 22.
RESULTADOS Y DISCUSIÓN
Optimización del método de análisis
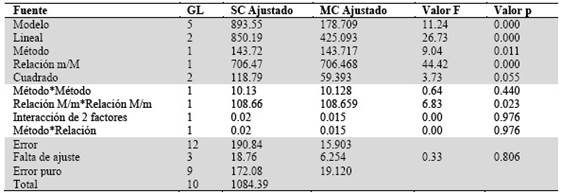
Los resultados por duplicado del diseño experimental se muestran en la Tabla 4. Se analizó la significancia de sus efectos principales y de interacciones entre factores a través del análisis ANOVA incluyendo los grados de libertad (GL), la suma de cuadrados ajustado (SC), la media de cuadrados (MC) los valores de distribución F y de probabilidad (p) para la prueba de hipótesis Tabla 5. Esto proporciona una visión detallada de los resultados estadísticos y permite una evaluación precisa de la significancia de los efectos analizados.
Tabla 4 Resultados de As en mg/kg de la muestra compuesta de suelos agrícolas del diseño experimental
De acuerdo con el análisis de varianza Tabla 5, tanto el método como la Relación Muestra/modificador (M/m) son significativos y no así la interacción Método - Relación M/m, ni el término cuadrático Método-Método. En cuanto al ajuste, no es necesario agregar otros términos.
El resumen de modelo de optimización del método de análisis de As, nos indica que existe una correlación aceptable del modelo a los datos, siendo este modelo descrito en la siguiente ecuación:
As = 22.3 + 9.76 Método - 13.52 Relación M/m- 1.59 Método*Método + 2.65 Relación M/m *Relación M/m + 0.029 Método*Relación M/m
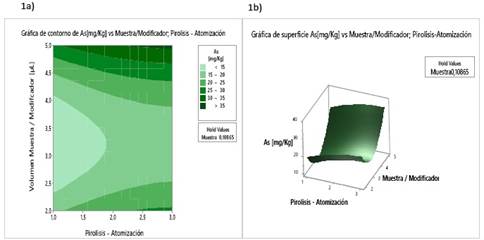
Figura 1 Análisis por superficie de respuesta; a) Grafica de contorno, b) Grafica de superficie de la concentración de As vs el método y la relación de volumen muestra/modificador
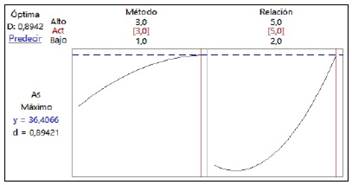
La descripción estadística de la desviación estándar (S), la correlación al cuadrado, (R-Cuad), la correlación al cuadrado ajustada, (R-Cuad ajustado), y la correlación predicha, (R-Cuad pred), se muestran en la Tabla 6. Con el modelo de optimización se ha obtenido el gráfico de superficie de contorno, donde se muestra una optimización de la relación volumen de muestra - modificador y el método (Figura 1a). En la Figura 1b se muestra el gráfico de superficie de respuesta e indica la sensibilidad en el análisis de As. Tanto el modelo de la ecuación, como los gráficos de contorno y de superficie, indican que el método 3 y la relación de 5:1 de volumen entre muestra y modificador son los apropiados para verificar la mayor sensibilidad instrumental para el análisis de As. Los métodos 3 y de relación, con una relación modificador de 5:1, muestran que alcanzan sus valores óptimos, lo cual se evidencia a través de las respuestas máximas entre las variables independientes (Figura 2).
Linealidad, exactitud y precisión
La linealidad, exactitud y precisión de las condiciones óptimas fueron comprobadas a partir de soluciones de referencia estables con concentraciones altas de elementos usuales en suelos. Esto de modo que las soluciones tengan matriz compleja y similar digestión de suelos, como el WWS2. Las lecturas de As se realizaron con el método de temperatura de pirolisis y atomización de 1300°C y 2250°C (Método 3), respectivamente. El método 3 contempla una relación de volumen de muestra / modificador 5:1, establecidas como condiciones óptimas. Se realizaron cinco pruebas con dos repeticiones en cada estándar.
Linealidad
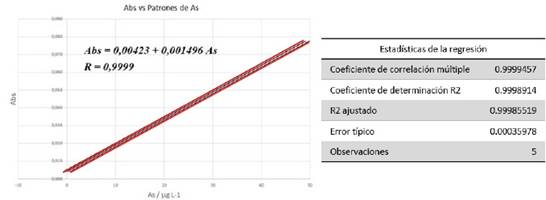
Los resultados de la regresión lineal de la curva patrón muestran un Coeficiente de correlación de R = 0.9999 y un coeficiente de determinación R2 = 0.99989 (99.989%). De este modo se cumple con los requisitos de linealidad y especificidad. En la Figura 3 se observa que los ensayos de las curvas patrón están dentro de los intervalos de confianza al 95 % (líneas rojas), demostrando una amplitud mínima a la recta de regresión lineal o curva de calibración, lo que indica la precisión y estabilidad en la linealidad. A partir de esta información se determina la sensibilidad del método y el intervalo de confianza de las muestras a medirse.
Límite de determinación y de cuantificación
Estos parámetros fueron obtenidos a partir de la lectura de 10 muestras blancos. Se utilizó el criterio de 3 veces la desviación estándar para la medición del límite de detección (LD), 10 veces la desviación estándar para el de cuantificación (LC)16),(17, y la pendiente de la curva de calibración. Se obtuvieron los siguientes valores de LD = 4.45 ± 0.34 µg/L, y de LC = 14,06 ± 0,7 µg/L. La concentración de límite de detección reportada en los manuales para el equipo es de 3.25 ± 0.52 µg/L.
Veracidad (exactitud) y precisión
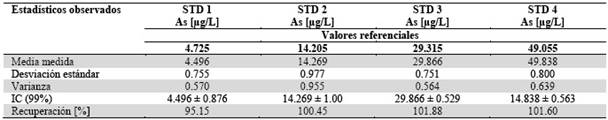
La veracidad (exactitud) se determinó a partir de la regresión lineal de los patrones estándar. Se comparó las concentraciones medidas observadas para cada patrón con los valores referenciales de concentración de dichos patrones (Figura 4) y, por otra parte, con el intervalo de confianza para cada patrón. En la Tabla 7 se muestran los valores de concentración medidos para los diferentes patrones. Se realizó una prueba de Grubbs sin encontrarse datos atípicos.
El criterio de aceptación es que la pendiente debe ser 1 y la ordenada al origen cero. De los datos puede observarse que la pendiente es 1 y el intervalo de confianza del intercepto indica una ordenada al origen de cero (Figura 4). A partir de esto se establece que el método de análisis optimizado cumple con el requisito de veracidad.
Con los datos de la Tabla 7 se determinaron los parámetros para la veracidad, que se muestran en la Tabla 8.
Tabla 7 Resultados para validación del método del análisis de As en µg/L (µg/L) por horno de grafito para los estándares preparados a partir del material de referencia Waste Water 2 (WWS2)
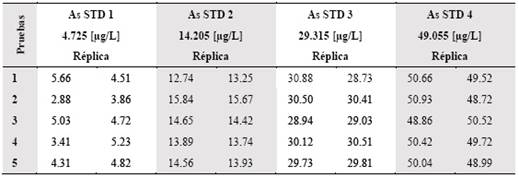

Figura 4 Comparación de la concentración referencial de los patrones o estándares y de la concentración obtenida por el método para las pruebas de precisión y exactitud
Los valores de intervalos de confianza al 99% indica que en todos los casos las concentraciones patrón se encuentran dentro de los rangos requeridos. Al mismo tiempo, los valores de Recuperación [%] se encuentran dentro de los rangos de 100% ± 5, cumpliéndose con el requisito de veracidad.
La precisión se verificó a través de las varianzas de cada serie de medidas, las que indican una buena precisión. Además, la prueba del Estadístico de Levene para homogeneidad de varianzas da una Sig. de 0.917 que nos indica que éstas son homogéneas. De este modo, la precisión del método es la misma en todos los casos.
CONCLUSIÓN
El análisis de As en suelos agrícolas con matrices complejas por HR-CS-GFAAS con digestiones ácidas es plenamente factible. El diseño experimental para la optimización del método indica que las condiciones óptimas de temperatura de pirólisis y atomización son 1300°C y 2250°C respectivamente (Método 3), y una relación de 25 µL de muestra con 5 µL de modificador en solución acuosa de Pd(NO3)2 al 0.1% y Mg(NO3)2 al 0.05%. Por otra parte, el ensayo del método optimizado cumple con los requisitos de linealidad, exactitud, precisión, las pruebas de Grubbs en ensayos la detección de datos atípicos y las pruebas de Levene para las pruebas de homogeneidad de las varianzas entre grupos. La curva de calibración experimental del método obedece a A=-0,1481+1.01996*(As, µg/L), con valores de recuperación entre 95,15% a 101,60%. Además, se ha establecido un límite de detección (LD) de 4.45 µg/L de As y un límite de cuantificación (LC) de 14.06 µg/L de As.












 uBio
uBio