Introducción
El conejo doméstico (Oryctolagus cuniculus) originario de los conejos europeos, desde la antigüedad a la fecha, es utilizado para la producción de carne, pelo, laboratorio científico y actualmente hobby1,2.
Si clasificamos a las especies domésticas por su fisiología digestiva, sin duda el conejo es un "caso diferente" y representa un ejemplo típico de adaptación a condiciones ambientales difíciles, especialmente desde un punto de vista alimentario, que fue estudiado desde mucho tiempo atrás, pero talvez no con la profundidad necesaria, pues no hay literatura suficiente y actualizada sobre su anatomía3.
El conejo presenta algunas particularidades anatómicas en su sistema digestivo, en primer lugar, su dentadura no presenta caninos, sus dientes no poseen raíz típica y son de crecimiento continuo, por lo que deben realizar un permanente desgaste por la acción de roer4.
La aprehensión de los alimentos la realiza por medio de los incisivos, lengua y su labio superior, que tiene una hendidura característica (labio leporino) y está dotado de una gran movilidad2. Su estómago es uno de los órganos voluminosos con capacidad de hasta 200 cm3 y se caracteriza por una musculatura débil, por lo cual el conejo no vomita. Anatómicamente se distinguen 2 sectores: la zona cardial o fundus, de paredes finas y que actúa como reservorio y el antro pilórico con mucosa glandular y paredes algo más gruesas4.
En el conejo, el proceso que caracteriza su fisiología digestiva se denomina cecotrofia. Este proceso consiste básicamente en que a partir de residuos alimentarios que ya sufrieron una digestión gástrico-intestinal, en el ciego y colon se produce un tipo de excreta (cecotrofo) con características físico químicas distintas a las fecas propiamente tales. Este cecotrofo es eliminado con cierta ritmicidad y a partir de la tercera semana de vida, el animal lo ingiere directamente del ano sometiéndolo a un segundo proceso digestivo5.
Luego ciego, cecotrofia y cecotrofo, constituyen respectivamente, el órgano, la función y el producto de síntesis de este complejo proceso que ha permitido al conejo lograr una alta eficiencia6,7.
En el conejo, el estómago presenta una motricidad bastante reducida. Esta atonía parcial permite que en el interior de estos crotines blandos se sigan desarrollando fermentaciones bacterianas con producción de ácido láctico y ácidos volátiles (A.G.V.)8.
El intestino delgado es similar al de otros monogástricos y mide alrededor de 3 m. Al final de este órgano se encuentra la válvula ileocecal que juega un rol importante en el paso del contenido intestinal a ciego y colon9.
En el neonato, el estómago posee un pH de 5.0 a 6.5. Esto lo convertiría en un medio de cultivo ideal para las bacterias de no ser por el hecho de que, en las tres primeras semanas de vida, está acidificado por la producción de un "aceite lácteo", compuesto de ácidos grasos decanoico y octanoico producidos por la reacción de las enzimas digestivas contenidas en la leche materna10.
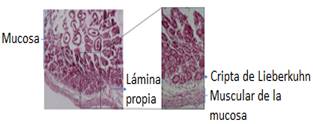
La organización histológica del esófago, estómago e intestinos es similar, y está formada por cuatro capas. La más interna es la mucosa, que consta de un epitelio que reviste el interior del tubo y que presenta variaciones morfológicas a lo largo del tubo digestivo relacionadas con su función conductora, secretora o de absorción. Independientemente de estas variaciones del epitelio, siempre descansa sobre una lámina basal. Debajo de la lámina basal se encuentra el otro componente de la mucosa: la lámina propia o corion, que es un armazón de tejido conjuntivo laxo, muy irrigado y con gran cantidad de células de defensa como son los macrófagos, células plasmáticas, linfocitos, etc. En zona más interna de la mucosa hay una capa de músculo liso llamada muscular de la mucosa, que permite los movimientos de la mucosa11.
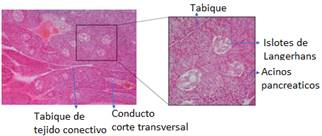
Las glándulas anexas como el hígado y el páncreas, liberan su contenido al interior del tubo digestivo. Ambas vierten al mismo conducto, el colédoco, que desemboca en el intestino delgado. El hígado secreta la bilis, que contiene, entre otros, los ácidos biliares necesarios para la absorción de las grasas. El páncreas secreta de manera exocrina enzimas digestivas que ayudan a la digestión. Ambas glándulas poseen también una función endocrina, liberando sustancias a la sangre, pero mientras que en el hígado es el propio hepatocito el que realiza tanto la función exocrina como endocrina, en el páncreas la función endocrina se localiza en lugares diferentes denominados islotes de Langerhans11.
El objetivo del presente estudio fue realizar un estudio histológico de los intestinos y glándulas anexas del conejo según su edad.
Materiales y métodos
El presente estudio se realizó durante los meses de noviembre, diciembre de 2020 y enero a mayo de 2021 en el Laboratorio de Investigación y Diagnóstico en Animales de Altura (LIDCAA), dependiente del departamento de Ciencia Animal de la Facultad de Ciencias Agrarias y Naturales (FCAN), de la Universidad Técnica de Oruro (UTO)-Bolivia, ubicado en el extremo Sud de la Ciudadela Universitaria a 3.5 km sobre la Carretera Internacional Oruro - Pisiga, a una altura de 3712 msnm, comprendido entre los paralelos 17°58’ 15’’ de latitud sud y 67°05’56’’ de longitud oeste.
Se seleccionaron 40 conejos mestizo Bouscath x California de diferentes edades, clínicamente sanos y divididos bajo el siguiente esquema:
Tabla 1 Detalle de conejos en estudio según edad
| Animales | Edad | Total |
|---|---|---|
| Conejos | 15 días | 10 |
| Conejos | 30 días | 10 |
| Conejos | 45 días | 10 |
| Conejos | 60 días | 10 |
Los conejos se criaron siguiendo procedimientos estándar y se les practicó la eutanasia siguiendo el protocolo de eutanasia animal. Se realizó un examen físico a todos los animales para garantizar que estaban condiciones sanitarias antes de la eutanasia. Los procedimientos de eutanasia se realizaron colocando 2 mL de cloroformo (CHCl3) en algodón y luego se colocaron en la nariz del animal12.
Examen histológico. Para la evaluación al microscopio óptico, las muestras se fijaron en formol tampón neutro al 10 % durante 24 h a temperatura ambiente. Tras la fijación, se procedió al procesamiento de los tejidos (deshidratación con un grado ascendente de alcohol, aclarado en xileno e impregnación (incrustación) en parafina). Inmediatamente después de la incrustación, las muestras se bloquearon con cera de parafina y se seccionaron mediante técnicas histológicas estándar, con un grosor exacto de 5 µm utilizando un micrótomo rotatorio13. Por último, las secciones se montaron en portaobjetos de vidrio y se tiñeron con las técnicas de tinción de hematoxilina y eosina13. Los portaobjetos se sumergieron en xileno y se montaron con cubreobjetos utilizando el medio de montaje DPX, se examinaron al microscopio óptico (Olympus).
Se hicieron 10 portaobjetos de duodeno, y para detectar el grosor de la mucosa, submucosa, muscular y serosa, mediante el uso del microscopio óptico con la escala (micrómetro ocular)14.
Se extirparon el ciego, el apéndice, el colon proximal, el colon distal y el recto del conejo, se lavaron con solución salina normal, se fijaron en fijador de Boun durante 24 h y, a continuación, se deshidrataron en grados ascendentes de alcohol, se aclararon en xileno y se incrustaron en parafina. Se cortaron secciones seriadas de 5μm de grosor y se tiñeron con hematoxilina y eosina15 para el examen histopatológico. Las imágenes se examinaron y fotografiaron con una cámara digital de microscopio. Las secciones se estudiaron con un microscopio óptico con micrómetro ocular y platina micrométrica. Se realizaron múltiples mediciones, de cada sección se midió el grosor de la mucosa, submucosa, muscularis externa y serosa. Se tomaron muestras de tejido de todos los individuos del estudio y se midieron 10 secciones por muestra de tejido16.
Resultados
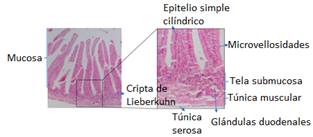
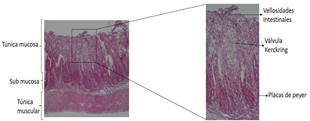
Descripción de la estructura histológica del duodeno, yeyuno, íleon del conejo según edad. El intestino delgado se compone de 3 segmentos: duodeno, yeyuno e íleon. Histológicamente al igual que el resto del tracto digestivo, el intestino delgado está formado por una mucosa, tela submucosa, túnica muscular y túnica serosa. La mucosa intestinal comprende el tejido epitelial simple cilíndrico, lamina propia compuesta de tejido conectivo laxo irregular y la muscular de la mucosa, en la lámina propia se encuentran muchos capilares sanguíneos y vasos linfáticos que se proyectan hasta la membrana basal del tejido epitelial.
En el intestino delgado, se registran 3 glándulas: criptas de Lieberkühn, glándulas de Brunner en el duodeno y las placas de Peyer a lo largo del intestino.
Duodeno. Como segmento anterior del intestino delgado rodea el páncreas, lugar donde son vertidos tanto el líquido biliar, como el jugo pancreático, con lo que se neutralizan el quimo acido procedente de la región pilórica del estómago.
La membrana mucosa del duodeno presenta vellosidades intestinales, revestidas por epitelio simple cilíndrico con microvellosidades en su superficie apical y lámina propia, en el duodeno las vellosidades tienen forma de hojas que de manera gradual adoptan forma de dedos a medida que se aproximan al íleon.
El epitelio de revestimiento de las vellosidades comprende principalmente: células absortivas o enterocitos, células caliciformes, además del epitelio de las criptas que, a su vez, contienen algunas células absortivas, células caliciformes, células entero endocrinas, células de Paneth y células madre, las mismas no presentan diferencias histológicas entre las edades estudiadas.
Los enterocitos son células cilíndricas altas, cada una con un núcleo oval en su porción basal, en su parte apical presenta microvellosidades y crea una chapa estriada. Las células entero endocrinas liberan hormonas intestinales como la secretina, colicistoquinina, péptido inhibidor gástrico y motilina. Las células caliciformes se distribuyen entre los enterocitos que son menos abundantes en el duodeno y aumentan en número en dirección al íleon, estas células producen glucoproteínas ácidas de tipo mucina, que se hidratan y originan el moco, con una función principal de proteger y lubricar la mucosa intestinal. Las células de Paneth se encuentran ubicadas en la parte basal de las criptas intestinales, son células exocrinas con gránulos de secreción en su citoplasma apical, estos gránulos contienen lisozima y defensina, moléculas que pueden permeabilizar y digerir la pared de las células bacterianas y Las células madre se localizan en el tercio basal de las criptas, entre las células de Paneth.
La submucosa del duodeno contiene, glándulas tubulares enrolladas y ramificadas denominadas glándulas de Brunner, sus células secretan moco alcalino (pH entre 8.1 y 9.3). Ese moco protege la mucosa duodenal contra los efectos de la acidez del jugo gástrico y neutraliza el pH del quimo, además de acercarlo al pH óptimo para la acción de las enzimas pancreáticas.
La túnica muscular del intestino delgado está compuesta de un estrato circular interno y otro longitudinal externo. La imagen histológica de las células musculares lisas depende del plano de corte (transversal o longitudinal).
Se observó que las glándulas mucosas (criptas de Lieberkühn) en la lámina propia se abren entre las bases de las vellosidades. Estas glándulas tubulares ramificadas simples revestidas por epitelio cuboidal a columnar bajo con núcleo basal y citoplasma acidófilo estaban presentes en todo el duodeno.
Yeyuno. Las vellosidades intestinales en el yeyuno e íleon se tornan puntiagudas, con ellas aumentan enormemente la superficie epitelial, por tanto, la cantidad de células epiteliales disponibles para la absorción.
En la base de las vellosidades intestinales del yeyuno se encuentran las glándulas intestinales o criptas de Lieberkühn. Estas criptas poseen su porción secretora y sus conductos secretores alcanzan la lámina propia hasta fusionarse con las vellosidades intestinales.
El proceso de absorción de los nutrientes en el yeyuno recae sobre las siguientes células: enterocitos, células caliciformes, células de Paneth, células entero endocrinas y células M.
Las células caliciformes son menos numerosas que los enterocitos, al igual que éstos, se distribuyen a lo largo de todo el intestino, donde liberan sustancias mucosas que recubren la superficie epitelial libre.
Íleon . La mucosa del Íleon comprende las vellosidades intestinales, formada por células epiteliales simple cilíndricos y su membrana basal continua con lamina propia. En la tela submucosa de Íleon, se localizan numerosas aglomeraciones de folículos linfáticos, conocida como las placas de Peyer, cada placa se compone de centros germinativos, cuando se observa desde la superficie luminal, aparece como un área de forma redondeada o elíptica sin vellosidades en la superficie.
La túnica muscular está bien desarrollada en estas regiones intestinales, el aspecto histológico de las células musculares lisas depende del plano de corte (transversal o longitudinal).
Válvula íleo-cecal, estructura anatómica que actúa a modo de válvula entre el intestino delgado, ciego y colon, tiene forma de cúpula convexa, rica en vasos linfáticos. Esta zona constituye el paso de la ingesta que impide su retorno. El íleon termina en el ciego, donde se encuentra una estructura de saco redondo (Sacculus rotundus), que permite al quimo pasar en una sola dirección hacia el ciego.
El intestino grueso.
Ciego. Es el órgano más voluminoso y de mayor capacidad, tiene forma sacular, de paredes delgadas y en su interior presenta de 22 a 24 pliegues dispuestos en espiral que permiten un aumento de la superficie de absorción de nutrientes. Termina en un gran apéndice rico en formaciones linfoides y que juega cierto rol en los procesos digestivos, ya que secreta un líquido seroso rico en bicarbonatos y es un sitio de activa fagocitosis bacteriana.
El colon se divide en una porción proximal de alrededor de 40 cm y con ondulaciones marcadas; posee una mucosa con un epitelio cilíndrico y con abundantes glándulas ramificadas. El colon proximal se delimita con colon distal que se caracteriza por presentar una zona de transición del epitelio cilíndrico al cúbico, rica en glándulas mucíparas.
Descripción de la estructura histológica de las glándulas anexas según edad.
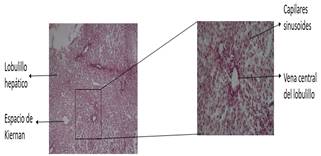
Hígado. La unidad estructural del tejido hepático son, los lobulillos hepáticos, el lobulillo hepático está formado por láminas de hepatocitos anastomosados entre sí, separadas por sinusoides que las irrigan con una mezcla de sangre venosa portal, que proviene de las vísceras abdominales y sangre arterial proporcionada por la arteria hepática. Las sinusoides confluyen en la vena central del lobulillo revestido de células endoteliales que forman una pared discontinua en la que intervienen los macrófagos (células de Kupffer).
El hígado es una glándula importante por constituir el órgano central del metabolismo de las sustancias absorbidas en el intestino, y por segregar liquido biliar, para emulsionar las grasas y alcalinizar el medio favoreciendo la acción enzimática del páncreas y del intestino.
Páncreas exocrino. La acción digestiva del páncreas exocrino se debe a las enzimas sintetizadas y segregadas con el jugo pancreático, las cuales son vertidas al intestino mediante el conducto pancreático. El jugo pancreático contiene una cantidad adecuada de enzimas digestivas que permiten la degradación de las proteínas (pepsina, tripsina, quimotripsina), del almidón (amilasa) y de las grasas (lipasa). El páncreas presenta islotes de Langerhans con función endocrina.
Discusión
El intestino delgado cumple un papel muy importante en los procesos digestivos al ser el principal responsable de la absorción de los nutrientes, además de recibir las secreciones biliares y pancreáticas que intervienen en la degradación de proteínas y grasas17. La superficie de la mucosa del intestino es mucho mayor que la serosa, debido a la presencia de los pliegues de Kerckring, aumentan la superficie tres veces18.
La mucosa integran un epitelio columnar, el tejido conectivo laxo en la lámina propia y la muscular de la mucosa, en la lámina propia se encuentran muchos capilares sanguíneos y linfáticos que se proyectan hasta la basal del epitelio, este forma proyecciones (vellosidades) hacia la luz, tienen microvellosidades en el borde estriado (ribete de cepillo) y se originan por división mitótica en la porción basal de las criptas, migran hacia la superficie para terminar descamando hacia la luz intestinal19.
Las glándulas submucosas duodenales son importantes en el diagnóstico diferencial de las regiones del intestino delgado20. La profundidad de la cripta en el duodeno fue significativamente mayor que en el yeyuno y el íleon. Kumar et al.21 en ovejas y Eurell & Frappier19 en otros animales domésticos.
Los espacios intercelulares entre los enterocitos están sellados mediante uniones estrechas y uniones adherentes, que impiden el paso de los productos de la digestión deforma inespecífica a través del epitelio. Esto provoca que la mayoría de las moléculas resultantes de la digestión que son incorporadas debe pasar por el interior de un enterocito22.
De acuerdo con los hallazgos de Neogy23 en conejos, el epitelio de revestimiento es columnar simple con bordes libres estriados con células caliciformes como las del duodeno. Besoluk et al.24, mencionan que las vellosidades tenían forma de huso en el íleon de conejos Angora.
En el colon proximal, gracias a movimientos peristálticos y antiperistálticos se produce el fraccionamiento de su contenido. Esto da origen a la producción alternada de crotines duros (heces) o crotines blandos (cecotrofos). Los primeros pasan al colon distal que juega un rol importante en la absorción de agua y electrólitos, en cambio los cecotrofos son cubiertos por una capa de mucina y no sufren mayores alteraciones8.
En el presente trabajo, se logró describir e identificar las diferentes estructuras histológicas que constituyen los intestinos y glándulas anexas del conejo entre los días 15, 30, 45 y 60 días, las diferencias histológicas marcadas según edad no se pudo registrar, la única diferencia que se pudo registrar fue en el tamaño y la cantidad de células que conforman los tejidos analizados. El estudio histológico de los órganos citados, nos permite aclarar que los tejidos digestivos completan su diferenciación desde una edad muy temprana en conejos, por tal razón desde los 15 a 60 días no hubo una diferencia histología marcada.












 uBio
uBio