INTRODUCCIÓN
El cultivo de naranja tiene sus orígenes en el hemisferio oriental siendo principalmente cultivada en China, desde allí inicio su distribución hasta convertirse en un fruto de importancia comercial. En 2022 la producción mundial logró un aumento de 1.8 millones de toneladas métricas (MMT), llegando a un estimado total de 49 MMT. Los principales productores de naranja son Brasil (16.9 MMT), China (7.6 MMT), la Unión Europea (6.1 MMT), México (4.3 MMT) y Estados Unidos (3.5 MMT). Sin embargo, los tres principales productores de zumo de naranja son Brasil (1.1 MMT), Estados Unidos (190,000 toneladas) y México (170,000 toneladas)(1.
Sin embargo, la producción citrícola se ha visto gravemente afectada por la enfermedad de Huanglongbing (HLB) inicialmente descubierta a finales del siglo XIX en China, conocida a nivel mundial como “Greening” por su nombre en inglés (Citrus Greening), o dragón amarillo (por la traducción literal de la palabra China Huanglongbing); una patología producida por la Alfa-Proteobacteria Candidatus Liberibacter spp2).
Estudios en México durante el 2010, permitieron estimar que las pérdidas debido al HLB rondaron los $239,000 millones de pesos, pues la superficie total del hospedante era 589,757.57 hectáreas (ha) con una producción de 8.3 MMT3. A la fecha, debido a condiciones de clima desfavorables y aumento de la ocurrencia de HLB, se estima que la producción en Estados Unidos se reducirá en un 13 % (siendo 3.5 MMT la producción más baja de los últimos 55 años), datos que contrastan con el aumento de la proyección China, pues su producción alcanzará el récord de 7.6 MMT, gracias al aumento de plantaciones y disminución de perdidas por la ocurrencia de HLB1).
La complejidad aumenta porque no existe una resistencia para el HLB y las estrategias de prevención se enfocan en mantener al margen la presencia de vectores que propaguen la α-proteobacteria aplicando técnicas combinadas de biocontrol e insecticidas. Sin embargo, no solo es importante el manejo de la enfermedad basado en el control del insecto vector, sino que el manejo de la fenología del cultivo debe estar basado en la relación patógeno-planta y sus variaciones a través del tiempo4).
Por otro lado, múltiples estudios se han enfocado en introducir genes de resistencia al HLB en cítricos bien sea utilizando técnicas moleculares o mediante tratamientos con inductores de resistencia vegetal, pero estos no han sido concluyentes porque se requiere controlar varios factores adicionales para conservar las características de sabor de las frutas y rendimientos, garantizar y controlar la expresión génica de las plantas en campo, además de conseguir que sean selectivamente eficientes en el control del HLB5
Por su parte, los productores han desarrollado una serie de estrategias de control que incluyen mantener al margen el vector, manejo nutricional mejorado, uso de vástagos tolerantes a HLB y portainjertos6, pero aún no ha sido posible identificar en detalle los posibles mecanismos involucrados en la tolerancia de los cítricos a la enfermedad, por ello presentamos esta revisión del impacto de la enfermedad en el cultivo de cítricos, abordando su etiología y reportes experimentales de estrategias genéticas de control, pues a la fecha las técnicas tradicionales de control han resultado ineficientes.
ESPECIES DE CÍTRICOS DE IMPORTANCIA
El género Citrus comprende diferentes especies nativas y cultivadas comercialmente (híbridos con mutaciones o cruces específicos) que se han obtenido a partir de cruces específicos que iniciaron en China hace más de 4,000 años, tiempo en el que los frutos eran ácidos, pequeños y llenos de semillas7. Al respecto, se ha logrado identificar un locus involucrado en la disminución de la acidez, ubicado en el cromosoma 8 (0.3-2.2 Mb) de todas las variedades de las mandarinas y naranjas dulces actuales de baja acidez, el cual habría sido introgresado del pomelo; además compararon el genoma de 58 genotipos representativos, y determinaron que los cítricos descienden de diez especies naturales de un área cercana al Himalaya, delimitada por el este de la India, el norte de Myanmar y el oeste de Yunnan; resulta entonces posible que un cruce entre C. reticulada (mandarina) y C. máxima (pomelo) dio lugar a un fruto comestible que siguió cruzándose8.
Hoy en día los más importantes incluyen la naranja dulce (C. sinensis), naranja agría (C. aurantium L.), toronja (C. paradisi), naranja pomelo (C. máxima), mandarina (C. reticulata), lima (C. aurantifolia), y limón (C. lemon) (9.
Variedades mejoradas
Predominan variedades cultivadas obtenidas por cruzamientos tradicionales y hay algunas que han sido modificadas genéticamente que resultaron exitosas en la expresión de características deseables en la fruta, fenotipo de la planta y resistencia. Sin embargo, estos procesos de mejoramiento son complejos y largos en tiempo pues el género presenta: alta heterogeneidad genética, incompatibilidad propia y cruzada, poliembrionía, esterilidad y una fase juvenil larga9. Aun así, la transformación genética funciona para la mejora genética de los cítricos ya que se basa en la introducción de rasgos específicos en genotipos conocidos, sin alterar los antecedentes genéticos de elite10 y, sobre todo, controlando las limitantes descritas anteriormente y por ende mejorando la eficiencia de las transformaciones y la posibilidad de regenerar plantas completas al lograr combinar las técnicas clásicas de botánica y citogenética con los avances de la genética, la biología molecular y la biotecnología.
La transformación de cítricos inducida por Agrobacterium tumefaciens ha sido estudiada y, a pesar de que los cítricos no son naturalmente susceptibles a esta bacteria, diversos estudios han logrado tasas de eficiencia de transformación que varían entre 0 y 45% utilizando cepas como LBA4404, C58, EHA101 y EHA10511. Se destaca la cepa A281 derivada de EHA105, que logró la formación temprana y frecuente de tumores en el epicotilo y tallos de varias variedades de cítricos (Naranja piña-dulce, lima mexicana, carrizo, limón fino, mandarina cleopatra y mediterránea). Los callos resultaron ser las células más competentes para la regeneración, lo que sugiere la importancia de utilizar medios de cultivo ricos en auxinas y períodos de oscuridad de 2 a 4 semanas para mejorar la eficiencia de la transformación10),(12.
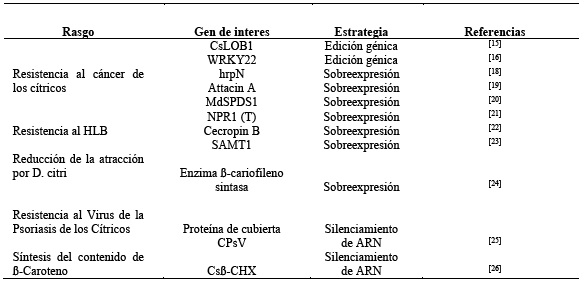
Otra técnica de transformación implica el uso de bombardeo de partículas microscópicas en los epicotilos de los cítricos con la que se ha logrado la transformación exitosa de Carrizo citrange mediante este método, donde el ADN de interés se inserta en el genoma de la planta13. También se ha utilizado la tecnología CRISPR/Cas9 para editar genes específicos en cítricos, como la modificación del gen CsLOB1 para mejorar la resistencia al cáncer de los cítricos y la edición del gen PDS en naranja dulce para lograr embriones transgénicos albinos7),(10),(14),(17),
La regeneración de plantas transgénicas de cítricos es un desafío debido a su recalcitrancia. Se han utilizado métodos como la organogénesis y la embriogénesis somática para regenerar plantas transgénicas de varias especies de cítricos. La orientación del explante, la polaridad, el contacto con la superficie del medio y los reguladores de crecimiento son factores críticos para mejorar la eficiencia de la transformación. Además, se han empleado técnicas de microinjerto para enraizar los brotes y embriones: y la edición del genoma también ofrece oportunidades para mejorar características de interés en los cítricos10).
Es importante resaltar que el proceso de desarrollo de variedades mejoradas de cítricos puede llevar muchos años, ya que implica la selección y evaluación de múltiples generaciones de planta; tradicionalmente es a través de cruces selectivos y la evaluación continua de las plantas que se logra obtener nuevas variedades mejoradas que se adapten a las condiciones y demandas de los productores y consumidores. Por su parte, los programas de mejoramiento genético se centran en características como sabor, jugosidad, resistencia a enfermedades, tamaño del fruto y otros atributos deseables10; en la tabla 1 se muestran algunos desarrollos biotecnológicos en citrus sinensis:
Por otro lado, hay ocasionalmente mutaciones esporádicas o espontáneas que resultan críticas para el desarrollo de nuevas variedades de cítricos, pero son poco comunes; y las mutaciones inducidas, que pueden aumentar intensamente la tasa de mutación, incrementando la variación genética disponible para la selección. Para lograr el mejoramiento se han utilizado mutágenos químicos, luz ultravioleta, rayos de alta energía, rayos X, neutrones rápidos, neutrones térmicos y rayos gamma (que se ha convertido en el inductor estándar responsable de la liberación de variedades mutadas comercialmente exitosas, ver tabla 2):
En la producción comercial de naranjas se suele hacer propagación de semillas para obtener portainjertos, mismos que luego se injertan con el cultivar deseado. Entre los factores que influyen en la selección del portainjerto se encuentra la compatibilidad con el vástago, el vigor deseado del árbol, tolerancia al estrés y las enfermedades transmitidas por el suelo; y aunque generalmente esta tolerancia no se transfiera al árbol injertado de manera que reduzca la incidencia de la enfermedad, si permite, por ejemplo, que el vástago mantenga su productividad bajo condiciones endémicas de HLB27.
ENFERMEDAD DE HUANGLONGBING (HLB)
Esta enfermedad es endémica de la provincia China de Guangdong, y aunque la principal característica es el amarillamiento general de las hojas, allí la sintomatología comúnmente fue agrupada en tres tipos: amarillamiento, moteamiento y visualmente similar a la deficiencia de Zinc (Zn) (28, ver Figura 1

Figura 1 Tipos de síntomas del HLB: A, brotes amarillos; B, hoja uniformemente amarillenta; C, hojas moteadas; y D, similar a la deficiencia de Zn. E1, fruto con cambio de color iniciado desde el extremo del tallo y E2, fruto con cambio de color iniciado desde el extremo de la flor.
Los síntomas de HLB en hojas pueden confundirse con deficiencias nutricionales o incluso con el daño de plagas y otras enfermedades, sin embargo, presenta características distintivas: diferentes estudios indican que el HLB estructuralmente afecta los tejidos del floema causando problemas para el transporte de nutrientes en las plantas hospederas29, esto desencadena la presencia de brotes vegetativos maduros amarillentos con moteado y distribución asimétrica, retraso en el crecimiento de plantas en desarrollo, menores porcentaje de rendimiento, producción de fruta deforme, con pobre coloración, con menos peso y tamaño, la que además puede desprenderse del árbol prematuramente30.
Histológicamente, los síntomas incluyen acumulación de almidón en las hojas, depósitos de calosa que bloquean los poros del tubo criboso y, finalmente, necrosis y colapso del floema. El desequilibrio metabólico se genera con el tiempo debido al suministro deficiente de compuestos de carbono, también se ha encontrado deficiencias de almidón en raíces estructurales grandes31, las frutas de árboles con HLB tienen menos azúcar y con el avance de la enfermedad se encuentra almidón en abundancia en las hojas maduras32.
Se considera a esta enfermedad como una de las más destructivas de los cítricos en el mundo por la severidad de los síntomas, la rapidez con la que se dispersa y porque aún no existe una cura definitiva, todo esto se correlaciona con los reportes de impacto epidémico, con niveles de incidencia que van desde el 26 % en Brasil, hasta el 100 % en China33.
Candidatus liberibacter spp (CaL)
Es el agente causal del HLB, estudios filogenéticos de la región 16s ARNr demuestran que pertenece a las α-proteobacterias. CaL. tiene de 0.2 a 0.3 μm de diámetro, una membrana característica de las bacterias Gramnegativas, una capa de peptidoglicano poco visible, y no tiene evidencia de flagelos. Se aloja en los tubos cribosos del floema y puede presentar formas redondas cuando termina su ciclo celular. Se transmite por insectos vectores, donde se encuentra en la hemolinfa y las glándulas salivales; también se puede dispersar por brotes, injertos y escasamente por semilla infectada (inóculo primario en campo) (34
De acuerdo con la Norma Internacional de Medidas Fitosanitarias (NIMF) No. 5 Glosario de términos fitosanitarios, C. Liberibacter spp. cumple con la definición de plaga cuarentenaria y tiene como hospedante principal a las plantas de la familia Rutaceae35
Evolución de la enfermedad a nivel mundial
Los primeros reportes fueron a finales del siglo XIX en el continente asiático en China, de ahí la nomenclatura de “Ca. L. asiaticus”. Luego se reportó en 1920 en Taiwán y las islas Filipinas. A finales de ese mismo año se detectó una nueva especie de Candidatus en Sudáfrica nombrada “Ca. L. africanus”. En 2004, se detectó la especie Ca L. asiaticus en la localidad de Araracuara, Sao Paulo, Brasil, posteriormente, se reportó una nueva especie de “C. Liberibacter spp.” en cítricos a la que se nombró “Ca. L. americanus”. En 2005, se reportó a “Ca. L. asiaticus” en Florida, EUA; y en 2015 se reportó por primera vez en Colombia la especie “Ca L. caribbeanus” (35).
El HLB representa una seria amenaza para la industria citrícola en México, un ejemplo de su impacto se observñó en los municipios de Tecomán y Armería, en el estado de Colima, donde entre 2010 y 2014 el HLB provocó la conversión de alrededor de 5000 hectáreas de plantaciones de cítricos a otros cultivos35; Esto resultó en una disminución de aproximadamente 84,721 toneladas de limón y una pérdida económica de MX$302,636,729. Además de los impactos económicos, esta enfermedad también impone restricciones en la movilización y comercialización de plantas y frutas cítricas en el país36).
Vector
Los vectores asociados con la propagación del HLB son Diaphorina citri (Hemiptera: Psyllidae) y Trioza erytreae (Hemiptera: Triozidae), nativos del continente asiático y africano respectivamente. La infestación de D. citri en arboles cítricos es asintomática, mientras que T. erytreae produce agallas globulares en la parte inferior de las hojas por la alimentación de las ninfas37.
El insecto inyecta la bacteria dentro del árbol, esta se mueve por el floema e impide la correcta circulación del agua y sustancias orgánicas derivadas de la fotosíntesis. Si un adulto del insecto se alimenta de una planta infectada con HLB, adquiere al patógeno antes de media hora y la bacteria se reproduce dentro de él. En cambio, a las ninfas les basta con alimentarse durante 15 minutos para incubar y transferir la bacteria a la semana, o semana y media38).
D. citri fue reportado por primera vez en México en 2002 en los estados de Campeche y Quintana Roo; En los años siguientes, se desplazó hacia las zonas costeras occidentales y del norte, y en solo 6 años se dispersó y se estableció en casi todas las zonas de cultivo de cítricos del país y en áreas urbanas donde existen plantas de cítricos36).
Transmisión de Candidatus Liberibacter asiaticus (CLas)
La transmisión de CLas está estrechamente relacionada al desarrollo del insecto, en el estado ninfal ocurre la adquisición y está se correlaciona directamente con la cantidad de CLas disponible en el tejido vascular de las hojas (Hosseinzadeh y Heck, 2023). CLas es responsable de la síntesis de calosa en la placa de tamiz del floema, lo que conduce a la obstrucción de los poros que proporcionan conexiones entre los elementos de tamiz adyacentes, limitando el transporte simplástico de los azúcares y almidones sintetizados en las hojas a los otros órganos de la planta39).
Un modelo de la dinámica entre el agente causal y el vector propone que las células bacterianas invaden las células epiteliales mediante endocitosis y se detecta la presencia de CLas en hemocitos y gotas de grasa. Luego, CLas llega a la lámina basal de la glándula salival, donde se reproduce en niveles elevados en adultos. Durante la salivación, D. citri inyecta saliva que contiene CLas en las células del floema de la planta, junto con proteínas efectoras salivales que fortalecen la inmunidad de la planta. En el floema, CLas se replica y se disemina por toda la planta. Las ninfas recién nacidas adquieren células CLas del tejido vascular en desarrollo, lo que provoca la muerte celular y la apoptosis, contribuyendo así al desarrollo de los síntomas de HLB. Además, CLas también puede invadir los órganos reproductores del insecto en niveles bajos, lo que resulta en la transmisión sexual o la infección materna de la descendencia. Las interacciones de CLas con el bacterioma del insecto son menos conocidas, y se necesita más investigación para comprender cómo CLas afecta a la comunidad de otros endosimbiontes bacterianos en el psílido40.
Autores reportan que a partir de semillas de frutos con HLB propagaron plántulas de diferentes especies de cítricos incluyendo naranja dulce para determinar si la enfermedad era trasmitida, los resultados indican que se redujo significativamente el peso de la semilla, la germinación y altura de las plántulas, sin embargo, estás no desarrollaron síntomas típicos de HLB a lo largo del experimento ni se pudo identificar la presencia de CLas por PCR en dichas plantas aun cuando se hicieron pruebas a lo largo de 6 años41).
GENOTIPOS CÍTRICOS TOLERANTES A CLAS
La definición de resistencia varía; en general, una planta resistente tendrá un nivel mucho más bajo del patógeno en comparación con una planta susceptible y no será sintomática. Los taxones susceptibles suelen tener una concentración de patógeno más alto y mostrarán síntomas. Sin embargo, la tolerancia es difícil de medir porque las plantas tolerantes pueden tener síntomas típicos de la enfermedad, pero continúan produciendo frutos. Por otro lado, la inmunidad se define como un estado en el que el patógeno nunca se detecta en la planta, aunque esté expuesta al mismo42).
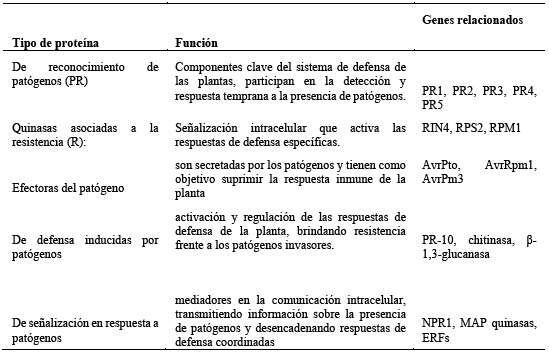
Las plantas pueden desarrollar inmunidad innata debido a defensas estructurales, químicas o basadas en proteínas43; estas proteínas y sus respectivos genes son objeto de intensa investigación en el campo de la biología de plantas y patología vegetal, ya que entender su funcionamiento y regulación es crucial para desarrollar estrategias de mejora de cultivos más resistentes a enfermedades. En la tabla 3 se mencionan algunas proteínas asociadas con la interacción planta-patógeno.
Especies cercanas taxonómicamente entre los cítricos parecen permitir la replicación de CaL por un corto período de tiempo antes de suprimirlos por completo, por ejemplo, la manzana de madera india (Limonia acidissima; sin. Feronia acidissima) es un huésped transitorio de CLas. También se ha informado que las especies de Murraya tienen concentraciones muy bajas de CLas y pueden actuar como posibles huéspedes transitorios de Liberibacter spp.42.
La respuesta de los cítricos al HLB aún es confusa, la variabilidad puede darse por los genotipos del huésped, la ubicación geográfica, las prácticas culturales o las diferencias en la patogenicidad de diversos aislados de CaL42; por ejemplo, se informó que las toronjas de muchos países asiáticos son resistentes al HLB, pero estudios posteriores de las mismas regiones geográficas informan que las toronjas son susceptibles. Murraya paniculata ha sido reportada como resistente a HLB de Taiwán, pero como susceptible a ambos Ca L. asiaticus y Ca. L. americanus de Brasil42),(44).
Algunos genotipos de cítricos han sido reportados como tolerantes a la infección de CLas y aunque los mecanismos moleculares involucrados aún son poco claros, la evidencia sugiere que se debe a una mejor actividad en la dinámica del floema. Estudios de la respuesta transcripcional de hojas de limón persa infectado con CLas mostraron una sobreexpresión de los genes ClPR1, ClNFP, ClDRL27, and ClSPK mientras que la expresión de los genes ClHLS1, ClRPP13, ClPDR1, and ClNAC fue reprimida44.
Al evaluar la tolerancia al HLB en la variedad de lima persa (triploide que se considera uno de los cultivares más tolerante) comparando su comportamiento a nivel fisiológico y bioquímico con el de su progenitor diploide, la lima mexicana, se infirió que la mayor tolerancia de la lima persa al HLB se asoció con un mayor tamaño de poro en la placa cribosa de las células del floema en el peciolo de la hoja en comparación con la lima mexicana. Además, al investigar muestras de peciolos infectados en hojas asintomáticas, observaron una mayor deposición de calosa en la lima mexicana en comparación con la lima persa, mientras que en hojas sintomáticas se observaron importantes deposiciones de calosa en ambos tipos de lima39. Estos resultados proporcionan información sobre rasgos específicos asociados con la poliploidía, como el tamaño de los poros del floema, así como los procesos de desintoxicación de la lima persa, los cuales ayudan a mantener el flujo del floema en la planta y, por lo tanto, resultan en una mejor tolerancia al HLB.
También se ha identificado que árboles transgénicos de naranja valencia (Citrus sinensis Osbeck) que sobre-expresaban el gen NPR1 de Arabidopsis thaliana (AtNPR1) se mantuvieron libres de HLB cuando se cultivaron en un sitio con presencia de la enfermedad, y tras realizar un análisis del transcriptoma se concluyó que AtNPR1 regula positivamente los mecanismos de defensa innata en los cítricos, fortaleciendo la resistencia y protegiendo eficazmente a la planta contra el HLB45.
Por otro lado, utilizando la técnica de secuenciación de ARN (ARN-Sec) se han evaluado las diferencias de expresión génica entre dos cultivares estrechamente relacionados después de la infección por HLB: los árboles tolerantes al HLB de pomelo "Jackson" y los árboles susceptibles al HLB de pomelo "Marsh”. Los autores lograron identificar un total de 686 genes con expresión diferencial (DE) entre los dos cultivares, de ellos, 247 genes mostraron una mayor expresión y 439 genes mostraron una menor expresión en los árboles cítricos tolerantes al HLB. Con esta investigación se identificaron algunos blancos potenciales, como genes similares a DMR6 y NPR1 para el mejoramiento de cítricos tolerantes a HLB en el futuro16).
Se reporta que el tipo de portainjertos utilizados para el cultivo de cítricos tiene un efecto sobre la incidencia de la enfermedad HLB en los cultivares vástagos41), considerando esto, Ramadugu y colaboradores en 201642 cultivaron plántulas a partir de semillas pudiendo evaluar los cultivares sin los efectos de confusión de los portainjertos. De este estudio solo dos accesiones (de un total de 90) fueron totalmente inmunes al HLB y seis se consideraron hospedantes resistentes. Los autores también concluyen que las dos accesiones de Poncirus estudiadas son resistentes al psilido y tolerantes a HLB, sin embargo, la tolerancia HLB registrada en las accesiones de Poncirus trifoliata no se observó en cuatro híbridos de Citrus y Poncirus probados en este estudio, citrange 'Rusk', citrangelo 'S-281', citrumelo 'Swingle' (C. paradisi Duncan × P. trifoliata ), y 'X639' (Citrus reshni Cleopatra mandarina × Poncirus trifoliata).
CONCLUSIONES
Entender los mecanismos involucrados en la transmisión y propagación del HLB es fundamental para lograr desarrollar diferentes estrategias de mejoramiento, inducción de tolerancia y control convencional en cítricos que puedan mitigar los efectos que esta enfermedad ocasiona en la producción mundial. Los avances tecnológicos, que van desde la inducción de mutaciones aleatorias hasta la edición precisa de genes utilizando CRISPR/Cas9, representan una serie de herramientas poderosas para abordar desafíos críticos como la resistencia al (HLB) y otras amenazas fitosanitarias.
Es importante destacar que, aunque estas tecnologías ofrecen un gran potencial para la mejora de cultivos, la percepción pública sigue siendo un factor fundamental. La comprensión y aceptación de estas técnicas por parte de la sociedad son esenciales para impulsar políticas menos restrictivas y permitir avances más rápidos en la investigación agrícola, por ello quisimos resaltar que la edición de genes no implica la introducción de material genético exógeno en las plantas, lo que debería contribuir a disminuir los sesgos y temores infundados.












 uBio
uBio