INTRODUCCIÓN
Biología y transmisión del virus
Los hantavirus son un grupo de virus que, debido a sus características morfológicas, genómicas y proteicas, están integrados en la familia Bunyaviridae de replicación propia. Además, mientras que los bunyavirus se transmiten al hombre por artrópodos, los hantavirus se transmiten a humanos a través de la inhalación de aerosoles contaminados provenientes de las excretas de roedores; sin embargo, la transmisión persona a persona también ha sido descrita (Gegúndez & Lledó, 2005; Puerta et al., 2006)
Su morfología esférica u oval, con un diámetro medio que oscila entre 90 y 120 nm. Estructuralmente son virus envueltos y exhiben en su superficie proyecciones compuestas por dos glucoproteínas G1 y G2. Su genoma está constituido por una molécula de ARN monocatenario. Los hantavirus se replican en el citoplasma de la célula huésped y las glucoproteínas se dirigen al complejo de Golgi, donde la mayoría de los hantavirus adquieren su envoltura por gemación. Estos virus se inactivan por calentamiento 56 °C durante 30 min, a pH ácido, con detergentes y solventes lipídicos, por luz ultravioleta y con altas concentraciones salinas (Gegúndez & Lledó, 2005)
Características clínicas y patológicas del virus
Los hantavirus son los agentes etiológicos, patógenos emergentes a nivel mundial que pueden causar diversos síndromes de enfermedades en todo el mundo, responsables de dos síndromes de enfermedad: fiebre hemorrágica con síndrome renal (HFRS) y síndrome pulmonar por hantavirus (HPS) o síndrome cardiopulmonar por hantavirus (HCPS)( Brocato & Hooper, 2019; Hangaragi, 2020).Tanto en animales como en humanos, las infecciones por hantavirus ocurren principalmente en células endoteliales pulmonares o renales y macrófagos, aunque el antígeno viral también está presente en muchos órganos diferentes (Avšič-Županc et al., 2019).
Es una enfermedad infecciosa caracterizada por síntomas generales, como fiebre, mialgia y dolor de cabeza, seguidos de disnea, edema pulmonar no cardiogénico, hipotensión arterial e insuficiencia cardiorrespiratoria. La tasa de mortalidad puede llegar al 52% de los casos.
Los hantavirus causan 2 enfermedades zoonóticas en humanos, que se manifiestan clínicamente en 2 formas distintas: Por lo general, la HFRS causa una infección de leve a moderada que presenta fiebre, dolores de cabeza y síntomas gastrointestinales, con progresión a hipotensión e insuficiencia renal aguda, pero con una tasa de mortalidad baja 1% a 15%. HPS, por el contrario, muestra un edema pulmonar no cardiogénico y compromiso respiratorio posterior, sin el componente renal de HFRS y una tasa de mortalidad de hasta el 60%, el curso de HFRS puede variar desde frecuentemente asintomático hasta un desenlace letal (Liu et al., 2019; Toledo et al., 2022)
Características epidemiológicas
Los roedores silvestres son reservorios del hantavirus en el que ocasionan una infección crónica con viremia persistente y asintomática. En nuestro país, el Oligoryzomys longicaudatus ratón colilargo y el Oligoryzomys microtis son los reservorios del hantavirus. También se sospecha la participación del Calomys laucha (minsalud.gob.bo). La endemicidad del hospedero/ patógeno callosus geográficamente podría ampliarse debido a eventos muy importantes (incendios, inundaciones, deforestación (Mollinedo, Z. et al. 2020).
Los brotes de Hantavirus están asociados a los siguientes factores: cambios estacionales, principalmente en caso de intensas precipitaciones pluviales, cambio en la dinámica poblacional de los roedores, debido a competencias ínterespecies y a la presencia de depredadores, alteración de ecosistemas por eliminación de depredadores silvestres, por intervenciones humanas, que incrementan el contacto entre el hombre y los roedores, inundaciones y riadas donde los roedores buscan zonas altas y también alimentos, épocas de cosecha y zafra donde se incrementa la población de roedores por la comida, almacenamiento inadecuado de granos y caña de azúcar (minsalud.gob.bo).
Uno de los factores antropogénicos asociados a la infección por hantavirus es la agricultura, pues muchas veces genera disturbios del hábitat natural al convertir bosques en terrenos de cultivo, que conlleva al incremento de la población de roedores en las áreas de cultivo o sus alrededores, algunos de los cuales han tenido evidencia serológica de hantavirosis (Romani F. et. Al, 2020).
En Sudamérica, los tres primeros casos fueron notificados en Brasil en 1993 y luego se han confirmado casos en Argentina, Paraguay, Uruguay, Chile, México, Colombia y Bolivia. La transmisión de los hantavirus se considera de alto riesgo para los habitantes rurales por la mayor probabilidad de exposición a los roedores silvestres. En cambio, en áreas preferentemente urbanas la trasmisión directa de persona a persona cobra fuerzas por el comportamiento humano y lugares de cantidad de personas cerrados (Serra, M. 2019).
Debido al hecho de que tanto la incidencia como la distribución geográfica de la infección por hantavirus han aumentado en los últimos años, estos virus transmitidos por roedores han recibido mucha atención como una amenaza para la salud pública mundial (Salehi, M. et. Al, 2021).
Los roedores se consideran reservorios de Hantavirus. Por lo tanto, cuanto mayor sea la exposición a los excrementos de roedores infectados, mayor será el riesgo de transmisión de hantavirus (Salehi, M. et. Al, 2021). Estos roedores han sido identificados en comunidades de algunos municipios de los Departamentos de Tarija (Bermejo, Padcaya, Yacuiba); Cochabamba (Eterazama, Samusabeth, Villa 14 de septiembre); Santa Cruz (Hardeman, Pailón, Okinawa, Montero, San Julián, comunidades de la Brecha Casarabe, Bañaditos - Portachuelo, Okinawa, Saavedra, El Puente, Vallegrande). Se alimentan principalmente de semillas y frutos (moras, maíz, arroz, plátano, soya, caña de azúcar y otros), además con hongos, insectos, etc. Son de hábitos nocturnos y sus madrigueras las construyen generalmente en superficies que están cubiertas por malezas y arbustos y generalmente a una distancia no mayor de 20 metros de cursos o fuentes de agua (minsalud.gob.bo). No existen datos de las regiones y brotes en el Departamento de La Paz.
Diagnóstico clínico y de laboratorio
El diagnóstico de laboratorio de las infecciones agudas por hantavirus se basa en la serología, la sospecha de casos de hantavirosis se produce por presencia de fiebre de menos de siete días de evolución y uno o más de los siguientes signos o síntomas: cefalea, mialgias, náuseas, vómitos, diarrea, dolor abdominal, decaimiento, dificultad respiratoria. A esto se suma la presencia de una de las siguientes situaciones: antecedente de viaje o estadía en zonas endémicas dentro de las cuatro semanas previas al inicio de los síntomas y haber realizado tareas laborales o recreativas de riesgo; haber tenido contacto estrecho con un caso confirmado de hantavirosis (Ceriani, L. 2019).
Los pacientes con hantavirus tienen anticuerpos IgM (fase aguda) y, por lo general, también IgG (fase convaleciente) presentes en el suero al inicio de los síntomas. Las pruebas serológicas más utilizadas son el ELISA indirecto de IgM e IgG, así como el ELISA de captura de IgM, que tienen una mayor especificidad que los ELISA indirectos. Los ensayos de inmunofluorescencia indirecta también se usan regularmente para el diagnóstico, pero tienen una especificidad más baja. Además, se han desarrollado pruebas inmunocromatográficas de anticuerpos IgM rápidas y fáciles de usar de 5 minutos y están disponibles comercialmente (Avšič-Županc et al., 2019). Los anticuerpos de la clase IgG contra los hantavirus persisten durante toda la vida del individuo y pueden usarse en estudios retrospectivos (Mattar, S. et. Al, 2015).
Aproximadamente el día 5 del contacto con el virus el sistema inmune empieza a producir como mecanismo de respuesta IgM, llegando a bajar considerablemente al día 40, que es donde la fase aguda de la enfermedad termina. Ocurriendo un efecto contrario con los niveles de IgG que empiezan a subir con mayor lentitud, llegando a los niveles más altos una vez que termina esta fase aguda de la enfermedad. (Avšič-Županc, T. 2019). Los títulos de IgG en sangre pueden permanecer elevados durante muchos años (Akar, N. et. Al, 2019).
El diagnóstico de laboratorio de los casos de infección humana por hantavirus se realiza comúnmente mediante el ensayo inmunoabsorbente ligado a enzimas (ELISA), cuyo objetivo es detectar principalmente los anticuerpos IgM asociados con la infección reciente. Tal diagnóstico es posible incluso en la fase aguda de la enfermedad, porque los anticuerpos en HCPS aparecen con la aparición de signos y síntomas (de Oliveira, V.& Faccini, A. 2020).
La infección por hantavirus también se puede confirmar mediante la detección del genoma del hantavirus en muestras de sangre o suero mediante RT-PCR. Tanto la RT-PCR tradicional como la cuantitativa se utilizan para detectar la viremia. Aunque la presencia de viremia varía, el ARN viral generalmente se puede detectar si se dispone de una muestra aguda (Avšič-Županc et al., 2019).
Se ha realizado un número limitado de estudios sobre estas infecciones en Bolivia y América del Sur, se han publicado menos de 20 estudios sobre hantavirus. El territorio boliviano presenta condiciones climáticas, geográficas y epidemiológicas propicias para la transmisión de muchas enfermedades zoonóticas y transmitidas por vectores. Los reservorios de ortohantavirus en roedores se encuentran ampliamente distribuidos en la mayoría de los departamentos, cubriendo grandes áreas donde factores ambientales tales como temperatura, humedad, precipitación, latitud y altitud, así como factores sociales, culturales, económicos y políticos son propicios para el desarrollo sostenido de una transmisión recurrente (Escalera, JP. 2020).
Por lo mencionado los objetivos de este trabajo son: diagnosticar Hantavirus mediante la identificación serológica de anticuerpos de tipo IgG e IgM, Identificar las zonas riesgo de contagio por Hantavirus en la ciudad de La Paz-Bolivia, conocer la distribución de los casos de Hantavirus.
MATERIAL Y MÉTODOS
El presente trabajo es un estudio transversal descriptivo, en el cual se procesaron 138 muestras de pacientes provenientes del noreste del Departamento de La Paz, con sospecha de Hantavirus con sus respectivas fichas epidemiológicas, entre los cuales había pacientes de diferentes grupos etarios y de ambos sexos. Para este estudio se realizó la técnica de ELISA (Inmunoensayo de Absorción Ligado a Enzimas) tanto para IgG como para IgM variedad ANDES (ANDV), usando para todas las muestras sueros de pacientes con sospecha de infección por Hantavirus enviadas al INLASA, con cuadro clínico significativo, es decir con más de 3 síntomas.
Las muestras fueron derivadas de diferentes centros y establecimientos de salud del noreste del departamento de La Paz (Los Yungas) los cuales se muestran en la figura 1.
Para el análisis estadístico de los resultados y diseño de gráficos, se utilizó una base datos en hoja de cálculo de Microsoft Excel Office 2010.
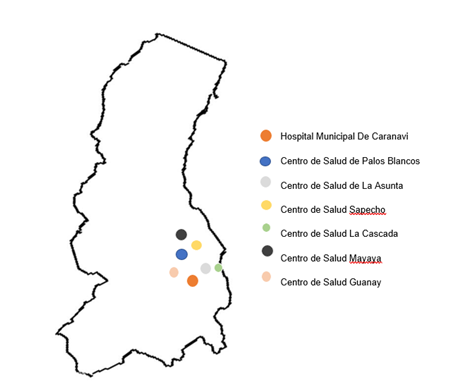
Figura 1 Ubicación de los centros de salud de muestras derivadas de casos sospechosos para Hantavirus. Fuente: Elaboración propia.
Para procesar estas muestras el personal de Laboratorio utilizo el equipo de protección personal (EPP) según protocolos OMS.
Se procesaron las muestras con el Kit Anti-Hanta virus ELISA (IgM) y (IgG), EUROIMMUN ANDV, que contiene tiras de microplacas cada una con 8 pocillos de reactivo desprendibles recubiertos con antígenos del virus Hanta recombinante. En el primer paso de reacción, las muestras de pacientes diluidas se incubaron en los pocillos según protocolo. Para detectar los anticuerpos unidos, se lleva a cabo una segunda incubación utilizando un anti-IgM y anti-IgG humano marcado con enzima (conjugado de enzima) que cataliza una reacción de color. La reacción final se lee en un rango del lector de ELISA a 405-620 nm.
RESULTADOS Y DISCUSIONES
Se procesaron 138 muestras en el laboratorio de Virología para IgG e IgM, se obtuvo que el 12.3% correspondiente a 17 muestras dieron positivas para IgG, el 3.6% correspondiente a 5 muestras que dieron positivos para IgM y el 84% restante dio negativo para serología. Algunos pacientes pueden ser negativos durante la fase aguda.
Considerando los resultados de IgG encontrado 12%, podemos explicar que la infección por Hantavirus se viene presentado periódicamente en la región de Los Yungas, pudiendo ser endémica en varias regiones. En los resultados obtenidos se demostró la circulación de Hantavirus en el noreste (Yungas) del Departamento de La Paz es de forma activa, comenzando a evidenciarse en proceso endémico estacional; el mayor porcentaje de casos presentados en los municipios de Palos Blancos, Caranavi y Guanay.
Tabla 1. Casos positivos para Hantavirus y su distribución geográfica
Cuando se examinan las respuestas de anticuerpos en las infecciones por hantavirus, el anticuerpo IgM aparece en una fase temprana después de la infección inicial.
Considerando solamente los pacientes que obtuvieron valores de IgM positivos y que están cursando la infección, en base a las fichas epidemiológicas, se pudo observar que los signos y síntomas más frecuentes en estos fueron la mialgia presentándose en los 5 casos positivos 100%, y el decaimiento general con artralgia en segundo lugar presente en 4 casos positivos, correspondiendo al 80%. En un estudio de participantes la infección por hantavirus puede tener síntomas como fatiga, fiebre, dolor muscular, dolor de cabeza, mareos, dolor abdominal, diarrea, vómitos, náuseas y dificultad para respirar (Nida, A. et. Al, 2019).
Según la frecuencia de signos y síntomas son los que se observan en la figura 2.
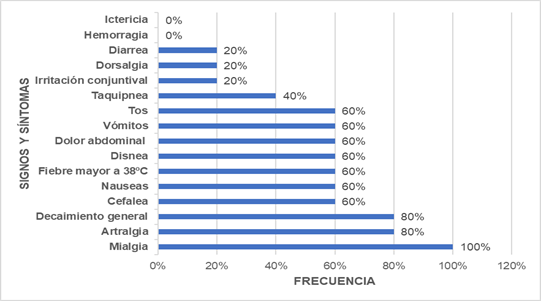
Figura 2 Signos y síntomas más frecuentes en la fase aguda de infección por hantavirus en los casos observados en Los Yungas, 2022.
En los casos positivos obtenidos se observa un mayor predominio del sexo masculino, con un porcentaje del 68% en comparación del sexo femenino con un 32%. En otros estudios realizados se evidencia también que existe mayor predominio del sexo masculino al femenino influenciado por la mejor repuesta inmune que expresan las mujeres. (Faber, M. et. Al. 2019).
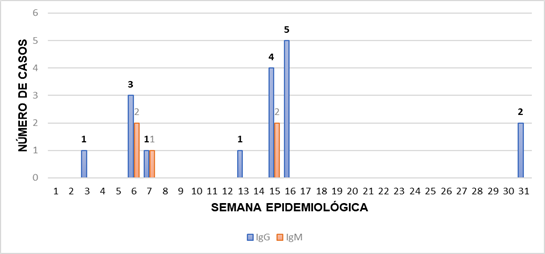
Entre las semanas epidemiológicas 15 y 16 se observaron más casos positivos para IgG correspondiente al mes de abril con un total de 9 casos, en cambio para casos positivos de IgM fueron las semanas 6 y 15 correspondiente a la 2da semana del mes de febrero y la 4ta semana del mes de abril correspondientemente con 2 casos. Esta observación puede evidenciar que la época estacional de probable aparición de casos oscila entre enero y abril de cada año con mayor frecuencia.
Figura 3. Casos de Hantavirus positivos obtenidos por semana epidemiológica. Fuente: Elaboración propia
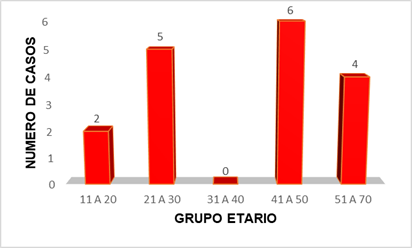
Las tasas de positividad para IgG en otros trabajos oscilaron en el grupo de edad de entre 46 a 70 años (Nida, A. et. Al, 2019). Los resultados obtenidos en nuestro estudio tienen relación con la bibliografía, el grupo etario más afectado fue el de 41 a 50 años, con 6 casos en total, en segundo lugar, el grupo etario de 21 a 30, con 5 casos en total, en tercer lugar, de 51 a 70, en cuarto lugar, de 11 a 20 solo 2, mientras que el grupo etario de 31 a 40 no presentó ningún caso positivo.
Figura 4. Distribución etaria de casos positivos para Hantavirus ELISA IgG. Fuente: Elaboración propia
En Bolivia hay evidencia serológica de circulación de orthohantavirus desde al menos 1982-1985 y continua hasta la actualidad (Escalera, JP. 2020). Se produjeron pequeños brotes en Bolivia entre 2002 y 2012, y en 2018 se notificaron un total de 40 casos en las regiones de Santa Cruz y Tarija de Bolivia (Hangaragi, P. 2020). No se tenían datos exactos del Departamento de La Paz. en la gestión 2022, entre los meses de enero a agosto de la gestión 2022 se pudo evidenciar casos de hantavirus detectados por serología en el presente estudio, con diferentes síntomas como: fiebre alta, dolores musculares, tos y dolor de cabeza y otros.
En estudios anteriores en otros países se observó también que la infección por hantavirus puede tener síntomas como fatiga, fiebre, dolor muscular, dolor de cabeza, mareos, dolor abdominal, diarrea, vómitos, náuseas y dificultad para respirar (Nida, A. et. Al, 2019).
Para la gestión 2022 el Sistema Nacional de Información en Salud - Vigilancia Epidemiológica SNIS reporta 163 casos sospechosos de Hanta virus, considerando las 138 muestras procesadas en el presente estudio se tiene un tamaño muestral representativo en el Departamento de La Paz en relación al total de muestras a nivel Nacional.
CONCLUSIONES
Se detectó por serología la presencia de anticuerpos (IgM) e (IgG) para hantavirus en muestras de suero, provenientes del noreste del Departamento de La Paz-Bolivia, en pacientes con sospecha de infección por Hantavirus mediante la prueba inmunoenzimática ELISA en el Laboratorio de Virología.
Mediante esta identificación serológica se evidencia la presencia de Hantavirus en 2 regiones de Los Yungas de La Paz, confirmando la existencia de infecciones activas y pasadas
Se observa un incremento en el número de casos entre los meses de febrero y abril de la gestión 2022 existiendo casos que no fueron probablemente reportados en la fase aguda de la infección.
Entre signos y síntomas se presentan con mayor frecuencia mialgia, artralgia, decaimiento general, cefalea nauseas, fiebre, dolor abdominal y otros, afectando más al sexo masculino y a un grupo etario de 41 a 50 años.












 uBio
uBio