Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim vol.33 no.4 La Paz dic. 2016
ARTÍCULOS ORIGINALES
Chemical study of seedlings of Galipea Longiflora (Evanta); A bio-guided approach
Gabriela Quiroga Selez, Carla Parra Lizarazu*, Efraín Salamanca Capusiri, Esther Flores Quisbert, Alberto Giménez Turba
Faculty of Pharmaceutical and Biochemical Sciences, Biochemical Drug Research Institute IIFB, Universidad Mayor de San Andrés UMSA, P.O. Box 3239, Av. Saavedra 2224, Phone 5912229021, La Paz, Bolivia, farbio@farbio.edu.bo
*CorrespondÍng author: mggs88.mggs@gmail.com
Abstract
The active principies (quinolinic alkaloids) from Galipea longiñora (Evanta) were isolated and characterized . These alkaloids showed low toxicity and a good in vitro activity against Leishmania strains. Seedlings of different ages of this medicinal species were developed. The work has been focused on the analysis of variations of quinolinic alkaloids present in extracts of the seedlings and the variation of the antiparasitic activity compared with each other and with the total alkaloids in adult specimens.
Five common major quinolinic alkaloids were identified in the adult-age tree and in the seedlings. Fourteen alkaloids were identified in the seedlings, compounds such as Shikimina, and 2-(3`,4`-metoxiphenylquinoline) appear when the seedlings get older.
As a rule the PAT shows better biological activity than CAT with an IC50 of 13,4![]() 1,2
1,2![]() g/mL on L. amazonensis and 7,2
g/mL on L. amazonensis and 7,2![]() 0.55
0.55![]() g/mL on L. braziliensis . This comparison between the variation of the antiparasitic activity against the variation of seedling size and chemical composition of PAT give us a pattern of which molecules will have influence in the biological activity.
g/mL on L. braziliensis . This comparison between the variation of the antiparasitic activity against the variation of seedling size and chemical composition of PAT give us a pattern of which molecules will have influence in the biological activity.
Keywords: seedlings, quinoline alkaloids, leishmanicidal activity, PAT.
Resumen
Spanish title: Estudio químico biodirigido de plantines de Galipea longiñora (Evanta). Los principios activos (alcaloides quinolinicos) de Galipea longiñora (Evanta) fueron aislados y caracterizados. Estos alcaloides mostraron baja toxicidad y una buena actividad in vitro frente a cepas de Leishmania. Se han realizado estudios sobre plantines de diferentes edades de Galipea longiñora. El trabajo se centró en el análisis de variaciones de la mezcla de los alcaloides quinolinicos presentes en los extractos de plantines y la variación de la actividad antiparasitaria; comparados entre sí y con alcaloides totales de corteza de especímenes adultos.
Se identificaron 5 alcaloides mayoritarios comunes en el árbol en edad adulta y plantines. En los plantines se identificaron hasta 14 alcaloides, llegando a reportarse compuestos como la: Shikimanina, y 2-(metoxifeniletilquinolina) cuando los plantines representan mayor edad.
En general, los PAT, presentan mejor actividad biológica con una IC50 de 13,4±1,2![]() g/mL sobre L. amazonensis y 7,2±0.55
g/mL sobre L. amazonensis y 7,2±0.55![]() g/mL sobre L. braziliensis que el CAT. Esta comparación entre la variación de la actividad antiparasitaria frente a la variación del tamaño del plantin y a la composición química de los PAT, nos da una pauta de cuáles serían las moléculas que influyen en la actividad biológica.
g/mL sobre L. braziliensis que el CAT. Esta comparación entre la variación de la actividad antiparasitaria frente a la variación del tamaño del plantin y a la composición química de los PAT, nos da una pauta de cuáles serían las moléculas que influyen en la actividad biológica.
INTRODUCCIÓN
La especie medicinal Galipea longiñora K. [sinónimo Angostura longiñora (Krause) Kallunki] tiene diversos nombres comunes, pero es conocida ampliamente por el nombre vernacular de "Evanta". Pertenece a la familia Rutaceae, es un árbol que crece hasta 12 metros de altura, presenta hojas trifoliadas alternas o superpuestas sobre la misma rama con un pecíolo frecuentemente alado y sus flores aparecen en forma de racimos. En Bolivia se la encuentra en los bosques tropicales de los últimos contrafuertes andinos en los departamentos de Beniy La Paz [1].
Esta especie se encuentra registrada en farmacopeas tradicionales como medicinal en la cura de problemas digestivos y principalmente de leishmaniasis cutánea (lepra blanca). Esta sintomatología puede ser interpretada por la medicina occidental, como antiparasitaria (leishmanicida). Esta planta es usada de manera tradicional por las etnias Tacana, Mosetén y Chiman. El uso tradicional más frecuente según los Tacanas es en forma de cocción de la corteza de tronco para el tratamiento de diarreas causadas por parásitos intestinales y como fortificante para niños y adultos; para el tratamiento de la leishmaniasis, la corteza fresca o seca es molida y aplicada directamente en forma de cataplasma sobre las úlceras, dos veces al día hasta que sane, además de beber la decocción [2].
Según la Organización Mundial de la Salud se estima que se presentan cada año 2 millones de casos nuevos en todo el mundo, de los cuales 1,5 millones corresponden a leishmaniasis cutánea. Sin embargo, los datos oficiales subestiman la realidad de la afección debido a que numerosos casos no son diagnosticados, y existen un gran número de casos asintomáticos. [3].
La leishmaniasis en Bolivia se encuentra geográficamente distribuida en el área rural de las zonas tropicales y subtropicales de los departamentos de La Paz, Beni, Pando, Santa Cruz, Cochabamba, Tanja y Chuquisaca [4]. Entre los años 1985-1991, investigadores del Instituto Boliviano de Biología de Altura (IBBA UMSA) y del IRD (Francia) estudiaron la actividad antiparasitaria de los extractos de hojas, raíces y corteza de Galipea longiñora (Evanta), habiéndose aislado e identificado 15 alcaloides quinoléicos [5,6,7]. Algunos alcaloides aislados de las hojas mostraron eficacidad y baja toxicidad in vivo contra leishmaniasis cutánea y fueron objeto de patentes (Chimaninas A, B, Cy D US4209519/15/04/93) [8, 9,10].
El uso tradicional de esta planta como antiparasitario en Bolivia está reconocido dentro de la lista de los recursos naturales terapéuticos aceptados; las normas para medicamentos naturales lo reconocen como medicamento seguro, eficaz y de calidad (Ministerio de Salud y Deportes, 2001) [11]. En la actualidad, el Instituto de Investigaciones Fármaco-Bioquímicas (IIFB), de la Facultad de Ciencias Farmacéuticas y Bioquímicas de la UMSA, forma parte de un equipo multidisciplinario que está llevando adelante estudios clínicos sobre la eficacia de formulaciones farmacéuticas, a base de los principios activos de Evanta, frente a la leishmaniasis cutánea, así cómo para el tratamiento de parasitosis intestinales. Se continua con trabajos de investigación sobre nuevas alternativas para diferentes tratamientos a partir de extractos vegetales. El objetivo del presente trabajo sobre Galipea longiñora, se enfoca en el uso de plantines como nueva fuente de principios activos. De los cientos de plantines producidos, sólo cerca de una decena llegan hasta adultos.
En esta investigación, presentamos los resultados de los estudios centrados en el análisis de variaciones de la mezcla de los alcaloides quinolínicos presentes en los extractos de plantines y la variación de la actividad antiparasitaria; comparados entre sí y con alcaloides totales de especímenes de 9 metros, colectados en la comunidad de Hernández, Provincia Sud Yungas del Departamento de La Paz. Los extractos obtenidos fueron evaluados por su actividad leishmanicida sobre formas promastigote, frente a cepas de Leishmania amazonensis y Leishmania braziliensis.
RESULTADOS
Un total de 113 plantines fueron recolectados y agrupados de acuerdo al tamaño que estos poseían. Para la obtención de alcaloides totales (PAT) los plantines de Galipea longiñora (Evanta) fueron utilizados en su totalidad (hojas, tallo y raíz) estos fueron molidos, pesados y sometidos a maceración etanólica, para luego obtener los AT por precipitación selectiva acido - base. Una vez obtenidos los extractos secos se determinó su rendimiento respecto a la masa de planta seca (Tabla 1), dividiéndose estos en tres grupos: A (de 25 a 60 cm), B (de 70 a 90 cm) y C (de 110 a 175 cm) esto de acuerdo al rendimiento de alcaloides obtenidos.
Como se puede observar los porcentajes de PAT obtenidos en los tres grupos de plantines (0.22, 0.59 y 0.93%) representan menos de la mitad del rendimiento de alcaloides totales de corteza (CAT) obtenidos de un árbol adulto (2%). Sin embargo a su vez se puede observar que mientras mayor edad tenga el plantin la cantidad de alcaloides obtenidos es mayor, llegando a ser ésta, un factor de importancia considerable, ya que influye en la cantidad total de principios activos y la estabilidad presentada por estos.
Caracterización de alcaloides de Evanta (Galipea longiñora) por técnicas cromatográficas
Análisis de los alcaloides de Galipea longiñora por cromatografía en capa fina TLC
Los PAT obtenidos se sometieron a un análisis por cromatografía en placa fina (TLC), frente al CAT del árbol adulto, los resultados de este análisis se detallan en la siguiente figura 1.
El análisis de los extractos de los PAT y el CAT revelan una banda mayoritaria con un Rf=0, 94 que evidencia la presencia del alcaloide 2 FQ en todas las muestras (Figura 1. A). Un sistema de elusión diferente permite evidenciar mejor las diferencias existentes en la presencia de ciertos componentes que no se observan en el CAT, así como la variación en abundancia de estos componentes y la presencia de nuevos componentes que solo se observan en los plantines de mayor edad (B).
Análisis de los alcaloides de Galipea longiñora por cromatografía de gases/masas
Se eligieron plantines de los grupos A, B y C (Tabla 1) para la identificación de metabolitos. Los resultados de CG/MS obtenidos nos permiten llevar a cabo el análisis de las relaciones isotópicas de los elementos ligeros presentes en los alcaloides propios de la Evanta para medir las pequeñas variaciones en la abundancia isotópica. De esta forma se han podido identificar y comparar los alcaloides presentes en los plantines comparándolos entre sí y además con los patrones de análisis obtenidos del fraccionamiento del CAT etanólico (IIFB-UMSA, La Paz, Bolivia; Universidad de IUBO-Tenerife, España); la asignación de las estructuras químicas de los alcaloides quinolínicos, se realizó por comparación del tiempo de retención, abundancia relativa y masa obtenida.
En los cromatogramas obtenidos puede observarse las principales diferencias entre los alcaloides presentes en la corteza del árbol adulto CAT y los presentes en los plantines (PAT): los cinco alcaloides mayoritarios comunes: la 2-n-propilquinolina (8), 2-n-pentilquinolina (7), 2-n-fenilquinolina (1), 4-metoxi-2-fenilquinolina (2) y la 2-(3',4'-metilendioxifeniletil)-quinolina (4). Así mismo se observa, en el espectro de los plantines, varios picos pequeños de diferente abundancia relativa, encontrándose entre la 2-n-pentilquinolina (7) yla 2-n-fenilquinolina (1), haciendo a ésta el área más variable, respecto a los alcaloides presentes en el árbol adulto, de las cuales, algunas pertenecen exclusivamente a las hojas. Figura 2 A.
Con la comparación entre los alcaloides de los grupos A, B y C (Figura 2. B), podemos observar que no existen grandes diferencias entre las abundancias relativas de los alcaloides presentes en los plantines estudiados; la mayor diferencia se encuentra al comparar la región que abarca los 55 a 78 minutos de retención, principalmente entre los 60 y 65 minutos; es en esta región donde se encuentran los alcaloides propios de las hojas i.e. Chimaninas A (9), B (10), C (11) y D (12).
También se observa un pico inidentificable a los 62,69![]() 0.03 minutos de retención (*), debido a que presentó un diferente fraccionamiento y un peso molecular en los distintos espectros de masas.
0.03 minutos de retención (*), debido a que presentó un diferente fraccionamiento y un peso molecular en los distintos espectros de masas.
Para analizar si, se presentaba un patrón en la abundancia relativa de los componentes del concentrado total de alcaloides en los plantines y el aumento de la edad de estos, se realizó un análisis comparativo de las relaciones de porcentaje de cada uno de los alcaloides. (Tabla 2).
Comparando la abundancia relativa de los alcaloides quinolínicos contenidos en los grupos de plantines se observa que ésta y por tanto la mezcla de alcaloides varía de acuerdo al aumento de la edad o tamaño del plantin.
Actividad biológica in vitro
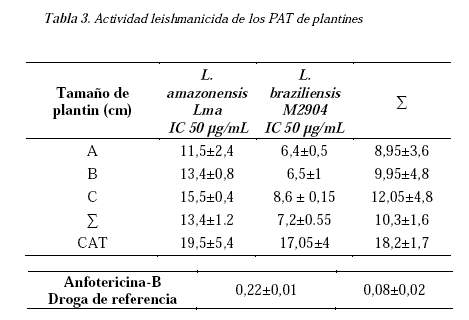
Se evaluó la actividad antiparasitaria de los PAT de los grupos A, B y C, sobre promastigotes de Leishmania, los resultados muestran fluctuaciones consideradas dependientes de la edad de éstos y las proporciones relativas de los alcaloides en cada uno de estos plantines. No se observan diferencias significativas entre ellos, sin embargo, existe una diferencia marcada respecto al árbol adulto (Tabla 3) presentando los plantines una mejor actividad biológica frente a las cepas Leishmania estudiadas.
La mejor actividad la presentó el plantin de 25 cm, tanto sobre L. amazonensis (CI 50= 11,5) como sobre L. braziliensis (CI 50= 6,4), siendo estas actividades menores a las presentadas por el CAT del árbol adulto: L. amazonensis (CI 50=19,5) y L. braziliensis (CI 50= 17,05).
En trabajos anteriores se reporta que la actividad del CAT puede ser muy variable incluso sobre las mismas cepas de Leishmania [12], ya que al ser una mezcla de diferentes alcaloides quinolínicos, éstos influyen de forma independiente en la actividad total [13].
DISCUSIÓN
Según datos reportados por otros autores, la abundancia relativa de los alcaloides de Galipea longiñora varía mucho en función del órgano de la planta utilizada, algunos compuestos se encontrarían en mayor abundancia (Ej: 2-n-propilquinolina (8)) o exclusivamente en hojas (Chimaninas), y otros en la raíz (Ej: 2-n-pentilquinolina (7)); la 2-n-fenilquinolina (1) está presente en todos los órganos de la planta, llegando a representar entre 40 y 70% de la abundancia relativa total. Luego, la proporción de alcaloides en este concentrado es muy variable [14, 15], como se observó en el análisis por cromatografía en capa fina (TLC). También, la aparición de compuestos en los plantines de mayor tamaño sugiere que las biosíntesis de algunos alcaloides se darían a edades mayores.
Cabe recalcar que en el presente estudio de trabajó con el plantin en su totalidad, es decir, hojas, corteza y raíz; es así que la comparación entre la variación de la actividad antiparasitaria frente a la variación del tamaño y/o edad del plantin y a la composición química de los PAT, nos da una pauta de cuáles son las moléculas que podrían influir de forma directa en la actividad biológica. Haciendo un análisis comparativo de la abundancia relativa de cada uno de los alcaloides, el tamaño, y la actividad biológica del plantin, podemos observar para el grupo A (menor tamaño) que es éste el que mejor actividad presenta frente a Leishmania. La principal diferencia se observa en la 2-n-pentilquinolina (7) que posee el doble de abundancia relativa (8,5%) a diferencia de los otros grupos; también se observa que las Chimaninas D (12) y C (11) presentan una abundancia ligeramente mayor.
Si bien los alcaloides quinolínicos influyen de forma independiente en la actividad total, es decir, que poseen por si solos diferente actividad biológica, la mezcla de los diferentes compuestos en proporciones definidas podrá incrementar y/o disminuir la actividad biológica total. Todos los datos obtenidos nos llevan a concluir que la edad de la planta tiene una importancia considerable e influye no solo en la cantidad total de principios activos producidos, sino también en las proporciones relativas de los componentes de la mezcla activa.
EXPERIMENTAL
Recolección del material vegetal
Los plantines de Evanta (Galipea longiñorá) fueron recolectados en el mes de septiembre de 2012 en la comunidad de Hernández (S: 15°21' 527" y O: 067°20'549"), provincia Sud yungas del departamento de La Paz, Bolivia. La identificación taxonómica se realizó mediante comparación, con muestras Vaucher (AS49 mayo de 1996 y SD17 septiembre de 1994) depositadas en el Herbario Nacional de Bolivia. Los plantines fueron secados al abrigo de la luz del sol hasta obtenerse pesos constantes.
Obtención del concentrado de alcaloides totales de plantin (PAT)
Hojas, tallos y raíces de plantines de Galipea longiñorá (Evanta) fueron molidos y macerados en un percolador con alcohol etílico en una relación 1:5 (p/v) durante 24 horas. Después de la filtración, el extracto etanólico crudo fue concentrado a presión reducida hasta sequedad. El extracto crudo se disolvió en HCL, 1N y luego se alcalinizó con NaOH 2N hasta pH básico (papel pH). Se extrajo contra CH2CI2 v/v 1:1 en embudo de separación liq-liq. Se repitió la operación tres veces. Después de la separación, NaCl anhidro fue adicionado a la fase orgánica acumulada con agitación magnética por 15 minutos para adsorber trazas de agua. Se filtró el NaCl. El filtrado (fase orgánica libre de trazas de agua) fue evaporada a sequedad a presión reducida para dar el PAT (rendimiento.....%).
Análisis de los extractos obtenidos por cromatografía en capa fina
Los extractos obtenidos de los plantines fueron sometidos a cromatografía en capa fina (TLC) utilizando placas de silicagel 60 F254 (Merck) con base de aluminio, se empleó un sistema de elusión compuesto por CH2CI2-: MeOH (5%) y Éter: Acetato de Etilo (10%) , las placas fueron reveladas bajo luz UV a 254 nm y 365 nm. La corrida de los extractos se realizó junto a un patrón de 2FQ para la comparación de Rf's.
Cromatografía de gases acoplada a espectrómetro de masas (CG/MS)
El extracto PAT fue analizado en un Cromatógrafo de Gases acoplado a Espectrómetro de Masas SHIMADZU, sobre una columna capilar CARBOWAX (0.25um x 30m), bajo las siguientes condiciones: T° del horno: 40°C por 5min y ratio 2°C/min, T° del horno: 220°C por 25 min, Inyector (250°C), gas carrier H2 (modo flujo 1.78mL/min), detector de masas 2 min - 120 min (start m/z 15, End m/z 400), detector de ionización a flama (FID) (250°C).
Evaluaciones antiparasitarias in vitro
La actividad de las muestras fue evaluada a través del método colorimétrico XTT (X-4251 Sigma-Aldrich) sobre cultivos in vitro del estadio promastigote de Leishmania: complejo Leishmania amazonensis (cepa Lma), complejo Leishmania braziliensis (cepa M2904). En cada modelo la CI50 del extracto fue determinada mediante análisis de regresión lineal (porcentaje de inhibición vs. logaritmo de la concentración del extracto) [15]. Ambas pruebas se realizaron en el Laboratorio de Quimioterapia Experimental del Instituto de Investigaciones Fármaco Bioquímicas de la Facultad de Ciencias Farmacéuticas y Bioquímicas de la Universidad Mayor de San Andrés (La Paz - Bolivia).
REFERENCIAS
1. Giménez A, Ávila JA, Ruiz G, Paz M, Udaeta E, Ticona JC, Salamanca E, Paredes C, Rodríguez N, Quints K, Feraudy C, Gutiérrez I, Chuqui R, Quenevo C, Dalence MF, Bascope M. 2005, Estudios químicos, biológicos y farmacológicos de Galipea longiñorá Krause. Rev Bol Quím.; 22(1), 94-107. [ Links ]
2. UMSA: IIFB-IIQ-IBBA, FONAMA-EIA. 1999, Tacana: conozcan nuestros árboles, nuestras hierbas. La Paz: Centro de información para el desarrollo. [ Links ]
3. Ministerio de Salud y Deportes. Situación general y tendencias. Respuesta del sistema de salud OPS/OMS representación Bolivia; 2004, Noviembre [acceso 20 de junio de 2014]. Disponible en:http://saludpublica,bvsp,org,bo/ass/analisissituacion/bolivia/perfil-bolivia-2004.pdf [ Links ]
4. Mollinedo S. coordinador. 2007, Leishmaniasis guía operativa para el control en Bolivia. 1ed. La Paz: Programa Nacional de Control de las Leishmaniasis. [ Links ]
5. Fournet A, Vagneur B, Richomme P, Bruneton J. 1989, Aryl-2 et alkyl-2 quinoléines nouvelles isolées d'une Rutacée bolivienne: Galipea ¡ongiflora.. Can J Chem.; 67, 2116-2118. [ Links ]
6. Fournet A, Hocquemiller R, Roblot F, Cave A, Richomme P, Bruneton J. 1993 Les Chimanines, Nouvelles Quinoléines Substituees En 2, Isolees D'une Plante Bolivienne Antiparasitaire: Galipea longíflora. J Nat Prod.; 56 (9), 1547-1552 [ Links ]
7. Muñoz MH, Mayrarque J, Fournet A, Gantier JC, Hocquemiller R, Moskowitz H. 1994, Synthesis of an antileishmanial alkaloid isolated from Galipea longíflora and of related compounds. Chem Pharm Bull; 42 (9), 1914-1916. [ Links ]
8. Fournet A, Gantier JC, Gautheret A, Leysalles L, Muñoz MH, Mayrargue J, Moskowitz H, Cavé A, Hocquemiller R. 1994, The activity of 2-substituted quinoline alkaloids in BALB/c mice infected with Leishmania Donovan. Antimicroh Agents Chemother. 33: 537-544. [ Links ]
9. Fournet A, Ferreira ME, Rojas A, Torres S, Fuentes S, Nakayama H, Schinini A, Hocquemiller R. 1996, In Vivo Efficacy of Oral and Intralesional Administration of 2-Substituted Quinolines in Experimental Treatment of New World Cutaneous Leishmaniasis Caused by Leishmania amazonensis. Antimicroh Agents Chemother, 40(11), 2447-2451. [ Links ]
10. Fournet A, Angelo A, Muñoz V, Hocquemiller R, Cavé A, Bruneton J. . 1993, 2-Substituted Quinoline Alkaloids as Potencial Antileishmanial Drugs. Antimicroh Agents Chemother, 37 (4), 859-863. [ Links ]
11. Estado plurinacional de Bolivia. Ministerio de salud y deportes. 2001, Normas para medicamentos naturales, tradicionales y homeopáticos. [ Links ]
12. Salamanca E. 2008, Actividad antiparasitaria múltiple de alcaloides totales de corteza de Galipea longíflora krause kallunki (Evanta) [tesis de Maestría]. La Paz: Instituto de Investigaciones Fármaco Bioquímicas. Universidad Mayor de San Andrés; [ Links ]
13. Giménez A., Ávila JA., Ruiz G., Paz M., Udaeta E. 2005, Estudios químicos, biológicos y farmacológicos de Galipealongiflora Krause. Rev Bol Quim. 22 (1), 94-107. [ Links ]
14. Espinoza B., 2011, Estudio de Plantas Antiparasitarias de Farmacopeas Tradicionales de Bolivia "Galipea longíflora Krause y Píper hispidum Swartz. [Tesis de post-grado]. Universidad Mayor de San Andrés. La Paz-Bolivia. [ Links ]
15. Llanos Medina F., Espinoza Cruz B., Salamanca Capusiri E., Chuqui R., Flores Quisbert N., Giménez Turba A. 2009, Extracción acuosa de corteza de Galipea longiflora y su actividad leishmanicida. Biofarbo 17 (2), 32-38. [ Links ]
16. Salamanca E, Ruiz G, Ticona JC, Giménez A. 2008, Método colorimétrico - XTT: como evaluación de alto rendimiento de sustancias con actividad leishmanicida. Biofarbo 16, 21-27. [ Links ]












 uBio
uBio