Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim vol.35 no.5 La Paz 2018
FULL ORIGINAL ARTICLES
Rice-generated Aspergillus spp., Aflatoxin b1, its detection and quantification by fluorometric and hplc methods
Aflatoxina b1 de aspergillus spp generado en arroz, su detección y cuantificación por métodos fluorométricos y hplc
Carla D. Parra Lizarazu*, Gabriela Quiroga Selaez, Alberto Giménez Turba, Esther Flores Quisbert
College of Pharmaceutical and Biochemical Sciences, Biochemical Drug Research Institute IIFB, Universidad Mayor de San Andrés UMSA, P.O. Box 3239, Av. Saavedra 2224, Phone 5912229021, La Paz, Bolivia, farbio@farbio.edu. bo
*Corresponding author: carlitaden2309@gmail.com
Received 10 31 2018 Accepted 12 23 2018 Published 12 30 2018
ABSTRACT
Aflatoxins are produced by toxigenic strains of Aspergillus spp as a part of their metabolic producís. Its toxicity causes severe health damage which makes them to be considered potent carcinogens. There are Aspergillus strains that in substrates such as rice (Oryza sativa) grow and produce mycotoxins at 30 °C.
Two analytical methods for the detection and quantification of aflatoxin B1 were developed; calibration curves were constructed to validate these methods. Aflatoxin Bl production was develop by strain 114 QD (Aspergillus spp.) in a médium containing 50 and 20 g of rice emulating when possible the storage conditions during incubation period.
The analysis of 50 and 20 g of rice extracts by high performance liquid chromatography (HPLC) gave average concentrations of aflatoxin Bl of 94, 93 and 24,64 ppb respectively. By fluorescence spectroscopy average concentrations of 133, 37 and 27, 23 ppb were determined. Aflatoxin Bl concentrations obtained by both analytical methods show a significant difference (P <0, 05) with respect to the amount of substrate, being higher the concentration of aflatoxin B1 with greater amount of rice in the médium, the sensitivity of these methods allows to detect this toxin from 6 ppb.
Keywords: Afíatoxin Bl, Aspergillus spp, Oryza sativa, Fluorometry, HPLC.
RESUMEN
Las aflatoxinas son producidas por cepas toxigénicas de Aspergillus spp como parte de sus productos metabólicos. Su toxicidad causa graves daños a la salud que los hacen ser considerados carcinógenos potentes. Existen cepas de Aspergillus que en sustratos como el arroz crecen y producen micotoxinas a 30 ° C.
Se desarrollaron dos métodos analíticos para la detección y cuantificación de la aflatoxina B1; Se construyeron curvas de calibración para validar estos métodos. La producción de aflatoxina B1 se desarrolló mediante la cepa 114 QD (Aspergillus spp) en un medio que contenía 50 y 20 gramos de arroz emulando, cuando fue posible, las condiciones de almacenamiento durante el período de incubación.
El análisis de 50 y 20 gramos de extractos de arroz por cromatografía líquida de alto rendimiento (HPLC) dio concentraciones promedio de aflatoxina B1 de 94, 93 y 24,64 ppb respectivamente. Por espectroscopia de fluorescencia se determinaron concentraciones promedio de 133, 37 y 27, 23 ppb. La concentración de aflatoxina Bl obtenida por ambos métodos analíticos muestra una diferencia significativa (P <0, 05) con respecto a la cantidad de sustrato, siendo mayor la concentración de aflatoxina B1 con mayor cantidad de arroz en el medio, la sensibilidad de estos métodos permite Detectar esta toxina a partir de 6 ppb.
INTRODUCCIÓN
Actualmente existen más de 200 tipos de mohos toxigénicos que bajo condiciones especiales son capaces de producir distintos tipos de micotoxinas. Las toxinas que más se han estudiado han sido las aflatoxinas. Sin embargo, toxinas como la Ochratoxina A {Aspergillus ochraceus) o la citreoviridina (Penicillium spp) revisten igual importancia [1].
Las aflatoxinas son toxinas naturales producidas por cepas toxigénicas del genero Aspergillus como parte de sus productos metabólicos [2]. Su toxicidad causa daños severos en la salud al ser consideradas como los carcinógenos más potentes producidos en la naturaleza [3], principalmente la aflatoxina B1.
Aspergillus spp. requiere ciertas condiciones especiales para su crecimiento y la producción de aflatoxinas. Por ejemplo, Aspergillus ñavus, la cepa más relacionada con la producción de aflatoxina, en sustratos tales como el arroz crece entre 6 y 45°C con un óptimo a 37°C y la producción de micotoxinas se efectúa entre 11 y 36°C con un máximo de producción a 30°C [4]
Aunque los Aspergillus crecen saprofíticamente, los productos alimenticios pueden servir como sustrato, favoreciendo la presencia de estos mohos. Factores como la capacidad toxigénica del hongo, la temperatura, el tiempo, la humedad, la luz, la atmósfera de almacenamiento y factores de tipo químico como la presencia de minerales o carbohidratos, pueden ayudar a crecer e incluso a producir aflatoxinas [5].
La presencia de Aspergillus no necesariamente implica presencia de aflatoxinas pues hay cepas no toxigénicas, como por ejemplo A. oryzae y A. niger que son usados en la producción de enzimas, péptidos y otros compuestos orgánicos, y A. sojae que es usado en la fermentación de salsa de soya [6,7]. De igual forma, la ausencia de Aspergillus en el alimento no implica que este esté libre de aflatoxinas, debido a que la toxina puede persistir aún después que el moho ha desaparecido [8,9]
Dado que la detección y cuantificación de estas micotoxinas reviste una gran importancia, varios métodos analíticos han sido implementados con el tiempo. La cromatografía en capa fina (CCF) fue el primer método utilizado para la determinación de aflatoxinas, pero fue sustituido debido a los progresos técnicos en cromatografía liquida de alta resolución (HPLC) y más adelante por los métodos de ELISA y técnicas fluorimétricas [10]. Estos últimos ofrecen costos más accesibles y rapidez con relación a la cromatografía liquida de alta resolución (HPLC), sin embargo, la cromatografía liquida de alta resolución es uno de los más métodos más confiables, selectivos y precisos para la detección y cuantificación de aflatoxinas.
En este trabajo se desarrollaron dos métodos analíticos para la detección y cuantificación de aflatoxina B1, uno por cromatografía líquida de alta resolución (HPLC) y otro por espectroscopia de fluorescencia, se construyeron curvas de calibración para poder estandarizar estos métodos y con ellos poder evaluar la producción de esta toxina por la cepa de trabajo 114 QD {Aspergillus spp.). La producción de aflatoxinas se realizó en un medio de arroz a 30 °C, en oscuridad y sin agitación emulando en lo posible las condiciones de almacenamiento de este cereal.
RESULTADOS Y DISCUSIÓN
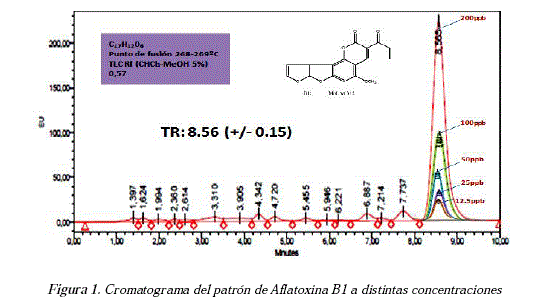
Se desarrolló un método por cromatografía liquida de alta resolución (HPLC) en fase reversa para la detección y cuantificación de aflatoxina B1. Para la elaboración de la curva de calibración, se analizaron 5 concentraciones en un intervalo de 12,5 a 200 ppb, el pico de aflatoxina B1 eluyó a un tiempo de retención de 8,56 (+/- 0,15) min. (Figura 1)
En la siguiente tabla se detallan los valores de las áreas obtenidas en tres repeticiones para cada una de las concentraciones analizadas.

Del estudio de linealidad se obtuvo un coeficiente de determinación R2 de 0,999 y un coeficiente de correlación de 0,9998, éste última muestra una correlación significativa entre la concentración de aflatoxina Bl y las áreas obtenidas, habiéndose obtenido un valor p < 0,05 (figura 2) para cada una de ellas. Con los valores del intercepto y la pendiente de la recta se obtuvo la ecuación 1 que se aplica para el cálculo de la concentración de aflatoxina Bl presente en las muestras por cromatografía liquida de alta resolución (HPLC).
La ecuación 1 permitió calcular la concentración experimental promedio para cada una de las soluciones patrón analizadas por el método desarrollado:

Para el análisis de exactitud se tomaron 3 concentraciones diferentes: 200, 50 y 12,5 ppb, por triplicado y se determinó la desviación estándar, el coeficiente de variación, el % de recuperación y el error relativo (%).

Elaboración de la curva de calibración de aflatoxina B1 por espectroscopía de fluorescencia
Se desarrollo un método por espectroscopía de fluorescencia para la detección y cuantificación de aflatoxina B1. Para la elaboración de la curva de calibración se analizaron 6 concentraciones de la solución patrón. El intervalo fue de 6 a 200 ppb, siendo esta última la minima concentración detectable por el equipo con respecto al blanco utilizado. Se trabajó a una longitud de onda de excitación de 365 nm, utilizada también en el análisis por cromatografía liquida de alta resolución (HPLC). Bajo estas condiciones se pudo observar que la aflatoxina B1 genera espectros de emisión con picos que se encuentran entre 408,00 y 446,06 nm, y una intensidad que va desde 2,90 hasta aproximadamente 40 a.u. Estos espectros se van desplazando cuanto más se eleva la longitud de onda de excitación. (Figura 3).
En la siguiente tabla se detallan los valores de Intensidad (a.u.) obtenidos en tres repeticiones para cada una de las concentraciones del patrón analizadas.
Del estudio de linealidad se obtuvo un coeficiente de determinación R2 de 0,997 y un coeficiente de correlación de 0,998, el cual muestra una correlación significativa entre la concentración de aflatoxina B1 y los valores de intensidad a.u. obtenidos para cada una de ellas (figura 4). Se obtuvo un valor p de < 0,05. Con los valores del intercepto y la pendiente de la recta se obtuvo la ecuación 2 que se aplica para el cálculo de la concentración de aflatoxina B1 presente en las muestras por espectroscopia de Fluorescencia.
La ecuación 2 permitió calcular la concentración experimental promedio para cada una de las soluciones patrón analizadas por el método desarrollado:
Para el análisis de exactitud se tomaron 3 concentraciones diferentes: 200, 50 y 12,5 ppb, por triplicado y se determinó la desviación estándar, el coeficiente de variación, el % de recuperación y el error relativo (%).
Desarrollo de la cepa 114QD en medio de arroz
Tras un periodo de incubación de 21 días, se pudo evidenciar el desarrollo de la cepa 114 QD en el medio arroz, los matraces conteniendo el arroz enmohecido se observaron bajo una lámpara de UV a 366 nm, constatándose la emisión de fluorescencia en el medio (Figura 5a y 5b).
El arroz resultó ser un buen sustrato inductor que permitió determinar la capacidad productora de nuestra cepa, si bien el arroz es un sustrato rico en hidratos de carbono, ácidos grasos, vitaminas y otros nutrientes que desencadenan la ruta de síntesis de las aflatoxinas, la composición del sustrato no es lo único que influye en la producción de estas toxinas, también se consideran las condiciones climáticas y de almacenamiento, por lo que la temperatura de trabajo considerada óptima para sustratos naturales [11], fue de 30°C. Otros parámetros como la oscuridad y la no agitación de los cultivos [12] también fueron considerados, se trabajó a la humedad ambiente del laboratorio.
Las condiciones de cultivo empleadas para el estudio permitieron emular ciertas condiciones a las que son sometidos los frutos secos y cereales como el arroz durante su almacenado. La presencia de aflatoxinas se evaluó cualitativamente por métodos de separación como cromatografía en capa fina CCF y cuantitativamente por cromatografía liquida de alta resolución (HPLC) y espectroscopia de fluorescencia.
Análisis por cromatografía en capa fina (CCF)
Para el análisis por cromatografía en capa fina, se determinó que la fase móvil más adecuada para la separación sea la de CHCl3-CH3OH 5%.
En la figura 6 se muestra el resultado del análisis por CCF a 366 y 254 nm de los extractos de 20 y 50 gramos de arroz, este reveló la presencia de bandas fluorescentes al mismo Rf del patrón de aflatoxina B1 empleado. El Rf del patrón fue de 0,56 y el Rf de las muestras de 0,58. Los Rf de aflatoxina B1 están en un rango de 0,4 a 0,7 [13]. Para poder identificar inequívocamente la presencia de aflatoxina B1 en los extractos se realizaron los análisis por HPLC y espectroscopia de fluorescencia.
Identificación y determinación de la concentración de aflatoxina B1 en los extractos de arroz por HPLC
El análisis por HPLC permitió encontrar en las muestras de 50 y 20 gramos el pico correspondiente a la aflatoxina B1 a un tiempo de retención de 8,56 minutos comparado con el patrón puro. Los cromatogramas revelan además la presencia de otros productos fluorescentes que no fueron caracterizados pero que se presume podrían derivar del metabolismo del hongo [14].
En la tabla 7 se representan el tiempo de retención y las áreas de los picos obtenidos de las muestras analizadas.
Para el cálculo de la concentración de aflatoxina B1 presente en las muestras se aplica la ecuación 1 hallada con la curva de calibración (Tabla 8).
En las muestras de 20 g de arroz se logró cuantificar a 21 días de cultivo una concentración promedio de aflatoxina B1 de 24,68 ppb, mientras que en las muestras correspondientes a 50 g de arroz se logró cuantificar 94,93 ppb.
Identificación y determinación de la concentración de aflatoxina B1 en los extractos de arroz por espectroscopia de fluorescencia
En la figura 9 se observa el espectro de emisión comparativo de los extractos de 50 y 20 gramos de arroz.
A partir de los valores de intensidad a.u. de los espectros obtenidos y con la ecuación 2 de la curva de calibración se obtuvo la concentración de aflatoxina B1 en las muestras.
En las muestras correspondientes a 50 y 20 g de arroz se logró cuantificar a 21 días de cultivo una concentración de aflatoxina B1 promedio de 133,37 y 27,23 ppb respectivamente.
La figura 10 muestra una comparación de los resultados obtenidos por cada método analítico. Los valores promedio hallados indican que la producción de aflatoxina B1 es significativamente mayor (p<0,05) a mayor cantidad de arroz utilizado como sustrato en la preparación de los medios.
Se demostró que los métodos aplicados en este estudio permiten sin duda alguna la detección y cuantificación de aflatoxina B1, incluso en matrices complejas como el arroz.
Sin embargo, una comparación de los métodos analíticos utilizados (figura 11) muestra que existe discrepancia en las concentraciones de aflatoxina B1 halladas para las mismas muestras. La determinación de aflatoxina B1 por fluorescencia es mayor a la de cromatografía liquida de alta resolución (HPLC).
Esta diferencia se debe principalmente a las características del método aplicado, los métodos cromatográficos como la cromatografía liquida de alta resolución (HPLC), son métodos selectivos capaces de producir una respuesta para el analito de interés, distinguible de las otras respuestas de los demás componentes de una mezcla compleja [15]. En cambio con la espectroscopia de fluorescencia, la fluorescencia a una determinada longitud de onda (360 nm) de la aflatoxina B1 permite su cuantificación, sin embargo, ésta resulta ser una técnica poco específica, ya que la fluorescencia detectada no solo puede ser exclusiva de las aflatoxinas presentes, sino que puede deberse a algún producto del sustrato o de otros metabolitos fluorescentes producidos por el hongo, tomándose la mezcla como una sola señal [14]. A pesar de haberse aplicado un método de purificación por cristalización por par de disolventes, no se pudo eliminar satisfactoriamente la interferencia debida a otros metabolitos presentes en los extractos, lo cual provocó resultados discrepantes entre ambos métodos. La aplicación de columnas de inmunoafinidad en futuros estudios permitirá sin duda eliminar estas señales interferentes, ya que estas columnas no solo permiten la purificación de los extractos, sino también el incremento en la concentración de las micotoxinas haciendo que la evaluación sea más fiable. [16,17]
EXPERIMENTAL
Material vegetal
Granos de Oryza sativa, adquiridos en el comercio local en La Paz, origen: Santa Cruz, Bolivia.
Elaboración de la curva de calibración de aflatoxina B1 por cromatografía liquida de alta resolución (HPLC)
Se empleó una solución patrón de aflatoxina B1 de 200 ppb , preparada mediante dilución de 1/1000 del estándar de 200000 ppb en 10 mL de fase móvil Agua/MeOH/ACN. Se realizaron otras diluciones ½ hasta obtener concentraciones de 100, 50, 25 y 12,5 ppb. Todas las diluciones se realizaron por triplicado. La solución patrón y las diluciones se mantuvieron en viales ambar en refrigeración a 4°C.
Las soluciones se analizaron por HPLC en un equipo Waters serie 1525 de bomba binaria con detector de fluorescencia modelo 2475 bajo las siguientes condiciones experimentales: Columna C18 (150 mm x 4,6 mm) 5 µm, fase móvil Agua/MeOH/ACN: 50:40:10 (v/v/v) con un flujo de 1 ml/min (isocrático), un volumen de inyección de 20 µl y tiempo de corrida de 10 min, las longitudes de excitación y de emisión del detector fueron de 365 nm y 435 nm respectivamente.
Elaboración de la curva de calibración de aflatoxina B1 por Espectroscopia de Fluorescencia
Se empleó una solución patrón de 200 ppb de aflatoxina B1, preparada mediante dilución de 1/1000 del estándar de 200000 ppb en 20 ml de metanol (grado HPLC), Se realizaron otras diluciones ½ hasta obtener concentraciones de de 100, 50, 25, 12,5 y 6 ppb. Todas las diluciones se realizaron por triplicado. La solución madre y todas las diluciones se mantuvieron en matraces Erlenmeyer cubiertos con papel aluminio en refrigeración a 4°C, esto para evitar la fotodegradación de la micotoxina.
Análisis de las soluciones patrón
Las soluciones patrón se analizaron por espectroscopia de fluorescencia empleando un espectrofluorimetro, modelo Varian Cary Eclipse, el análisis se llevó a cabo bajo las siguientes condiciones de trabajo: longitud de onda de excitación (365 nm), longitud de onda de emisión Barrido (400 nm- 600nm), apertura de excitación y emisión (5), Detector PMT Medio (800v) y velocidad de barrido Medio (600 nm/min).
Tras su análisis se representó la curva de calibración con los valores de intensidad (a.u.) en el programa Excel 2007 obteniéndose la ecuación para el cálculo de la concentración de aflatoxina B1 por espectroscopia de fluorescencia.
Producción de aflatoxina B1 por la cepa de Aspergillus spp. (114QD)
La capacidad de la cepa 114 QD para producir aflatoxina B1 fue determinada empleando arroz como sustrato natural.
Preparación del medio de arroz para la producción de aflatoxina B1
En matraces Erlenmeyer de 250 ml se colocaron 20 y 50 gramos de arroz pulido hidratado con 25 ml de agua destilada, se esterilizó en autoclave a 121°C por 15 minutos, posteriormente se inoculó el medio con 200 µl de una solución de esporas a una concentración de 1x106 esporas/ml. Los matraces se dejaron incubar por 21 días a 30°C en oscuridad y sin agitación para emular en lo posible las condiciones de almacenamiento.
Extracción de aflatoxinas
Finalizado el tiempo de incubación de 24 horas, se realizó la extracción de las aflatoxinas de los cultivos mediante el siguiente protocolo:
Al arroz enmohecido contenido en los matraces se le añadieron 200 ml de acetato de etilo, esto con el fin de extraer las aflatoxinas provenientes no solo del sustrato sino también del micelio. El contenido de cada matraz se mezcló por 5 minutos en licuadora (apta para solventes), los licuados obtenidos fueron filtrados por una capa de algodón y gasa, y colectados en balones a los cuales se los protegió de la luz hasta el proceso de purificación.
Purificación de los extractos de arroz
Para poder purificar los extractos se realizó la cristalización por par de disolventes, tomando ventaja de las características de solubilidad de estas moléculas. A cada extracto se le añadió poco a poco aproximadamente 8 ml de CH2Cl2 y gota a gota 4 ml de éter de petróleo 20/40, luego de observada una ligera turbidez los balones se taparon, protegieron de la luz y dejaron a -20°C por 72 horas. Pasado este tiempo al contenido de cada balón se le añadió nuevamente 3 ml de éter de petróleo 20/40, se filtró y colectó, los papeles filtro utilizados fueron lavados con CH2Cl2 y esta fracción también se colectó, ambas fracciones se concentraron al vacío en rotaevaporador
Análisis de los extractos de arroz por cromatografía en capa fina (CCF)
Los extractos obtenidos fueron analizados en placas analíticas de silicagel 60 F254 (Whatman) con base de aluminio. Se probaron 2 fases móviles, CHCVAcetona (90:10) y CHCl3/MeOH (95:5). La corrida de los extractos se realizó junto a la solución madre de aflatoxina Bl usada como patrón para la comparación de Rf's., las placas fueron reveladas bajo luz UV a 366 nm.
Cuantificación de aflatoxina B1 en los extractos de arroz por HPLC
Cada extracto fue resuspendido en 1 ml de la fase móvil Agua/MeOH/ACN y sometido a ultrasonido por 30 segundos, luego los preparados fueron filtrados por membranas de 0,45 µm antes de su inyección y analizados por el programa ya descrito, La concentración de aflatoxina B1 producida se determinó por la ecuación 1.
Cuantificación de aflatoxina B1 en los extractos de arroz por Espectroscopia de Fluorescencia
Cada extracto fue resuspendido en 20 ml de metanol, filtrado y analizado bajo las condiciones ya descritas. La concentración de aflatoxina B1 producida se determinó por la ecuación 1.
RECONOCIMIENTOS
Los autores agradecen a la Unidad de Productos Naturales del Área de Química Farmacéutica del Instituto de Investigaciones Fármaco Bioquímicas (IIFB) por todo el apoyo para el desarrollo de esta investigación.
REFERENCIAS
1. Valladares, L., 1988, Introducción al tema micotoxinas y micotoxicosis, Bol. Micolog., 4, 1-20. [ Links ]
2. Trail, F., Mahanti, N., Linz, J., 1995, Molecular biology of aflatoxin biosynthesis, Microhiology, 141, 755-765. [ Links ]
3. Montesano, R., 1997, Hepatocellular carcinoma: From gene to public health, JNati. Cancer Inst., 89, 1844-1852. [ Links ]
4. Gimeno A. https://www.engormix.com/micotoxinas/articulos/principales-factores-condicionantes-desarrollo-t26065.htm,access date 09/25/2018
5. Ellis, W., Smith, J., Simpson, B., Oldhman ,J., 1991, Aflatoxins in food: occurrence, biosynthesis, effects on organisms, detection, and methods of control, Crít RevFood Sci Nutr, 30(3), 403-439. [ Links ]
6. Hesseltine, C.W., Wang, H.L. Fermented Foods, In: Prescott & Dunn's Industrial Microhiology, ed by Prescott, S.C., Dunn, C.G., Reed, G., 1982, 4ttl ed., AVI Publ. Co., Westport, Connecticut, U.S.A, 492-538. [ Links ]
7. Yu, J., Proctor R.H., Brown, D.W., Abe, K., Gomi, K. Machida, M., Hasegawa, F., Nierrman, W., Bhatnagar, Cleveland, E., Genomics of economically significant Aspergillus and Fusañum Species, In: Applied Mycology and Biotechnology, Vol. 4, Fungal Genomics, ed by Arora, D.K., 2004, Elsevier B.V., Amsterdam, The Netherlands, 249-283. [ Links ]
8. Santos, O., 1999, Importancia y efectos de la aflatoxina en los seres humanos, MedUNAB, 2 (6), 124-129. [ Links ]
9. Armijo, J., Calderón, C.J., 2009, Esquema de acciones para evitar, controlar desinfectar productos de hongos y aflatoxinas, Rev. Per. Quím. Ing. Quím.,, 12(2) ,15-2. [ Links ]
10. Stroka, J., Anklam, E., 2002, New strategies for the screening and determination of a£atoxins and the detection of a£atoxin-producing moulds in food and feed, Trends in Analytical Chemístry 21 (2),90-95. [ Links ]
11. Nandi, B., Haggblom, P., 1984, Production of aflatoxin in rough rice under different storage conditions, Acta. Agrie. Scand., 34,128-132. [ Links ]
12. Bennett, J.W., Dunn, J.J., Goldsman, C.I., 1981, Influence of white light on production of aflatoxins and anthraquinones in Aspergillus parasiticus, Appl. Environ. Microbiol, 41 (2), 488-491. [ Links ]
13. Association of Official Analytical Chemist. Official methods of analysis of the AOAC. 15 edición, 1999, 1185-1201. [ Links ]
14. Espinosa, A, Conteras, L.M., Muñoz, R., Millán, J., Guevara, R, Torres, I., 2011, Methods for detection and Quantification of Aflatoxins. Aflatoxins - Detection, Measurement and control., http://www.intechopen.com/books/aflatoxins-detection-measurement-and-control/methods-for-detection-and-quantification-of-aflatoxins, access date 09/25/2018. [ Links ]
15. ICH Q2A. Text on validation of Analytical Procedures: definitions and terminology, 1 June 1995. [ Links ]
16. Stroka, J., Van Otterdijk, R., Anklam, E., 2000, Immunoaflínity column clean-up prior to thin layer chromatography for the determination of aflatoxins in various foods matrices, J Chromatogr A, 904, 251-256. [ Links ]
17. Scott, P.M., Trucksess, M.W., 1997, Application of immunoaflínity columns to mycotoxin analysis, J. AOAC Int, 80(5), 941-949. [ Links ]












 uBio
uBio