Una de las principales causas de consulta médica y la principal justificación para dar recetas de antibióticos son las infecciones bacterianas1. Empero, el uso indiscriminado o prolongado de estos medicamentos causa acrecentamiento de bacterias resistentes contra los antimicrobianos de empleo habitual. Por ello, Giono et al.2, sostiene que el incremento de la resistencia bacteriana es un problema que amenaza la salud.
Desde que el ser humano emplea las plantas para tratar, prevenir y mejorar diversas enfermedades3, éstas forman parte tanto de la historia antigua como de la moderna4, debido a que poseen propiedades farmacológicas que derivan de metabolitos secundarios sintetizados por la misma planta como es el caso de los aceites esenciales5, extraídos mediante: prensado, maceración, destilación por arrastre de vapor y otros métodos6.
Según Choque et al.7, Bolivia ofrece una gran diversidad de plantas medicinales, con aproximadamente 3 000 especies identificadas, entre ellas la Minthostachys mollis más conocida con el nombre de muña, que en investigaciones realizadas por Armas et al. bn8, y Campo et al.9, atribuyen que el aceite esencial de esta planta posee efecto antibacteriano y antimicótico.
El objetivo principal de esta investigación fue comparar in vitro la actividad antibacteriana del extracto y el aceite esencial de las hojas de muña (Minthostachys mollis) para comprender y confirmar la actividad antibacteriana atribuida al aceite esencial de muña. La hipótesis planteada fue: el extracto y el aceite esencial de muña tienen una actividad antibacteriana in vitro similar contra dos géneros y cinco cepas bacterianas patógenas.
Materiales y métodos
Trabajo experimental in vitro, transversal, prospectivo y enfoque cuantitativo, realizado en el Centro de Fármacos Alimentos y Cosméticos, Facultad de Ciencias Farmacéuticas y Bioquímicas, Universidad Mayor de San Simón.
Material vegetal: dos kilogramos de hojas de Minthostachys mollis se recolectaron de un entorno montañoso, con clima templado correspondiente del municipio de Mizque ubicado al sud este del departamento de Cochabamba. Para la recolección de las hojas de muña se consideró: que sean de la misma área geográfica, con dimensiones de 2 cm de ancho por 3 cm de largo, que no presenten ningún daño.
Procesamiento: con solución de hipoclorito de sodio fueron desinfectadas las hojas de muña, secadas a 40 °C por 48 horas en una cámara climática, moliendas en un mortero de porcelana con un pilón y tamizadas en un tamiz de acero inoxidable.
Elaboración del extracto: se elaboró extracto etanólico al 10% mediante maceración, el cual fue filtrado a través de papel filtro en un embudo, concentrado en un rotavapor a 50 °C, 200 rpm de velocidad y una presión de vacío de 40 mbar, conservado en un refrigerado entre 2-8 °C de temperatura.
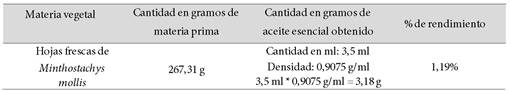
Obtención y rendimiento: mediante hidrodestilación por arrastre de vapor fue obtenido el aceite esencial, metodología utilizada por Huari10, con el método de Laura11, se determinó el rendimiento en porcentaje, mediante la siguiente fórmula:
P2 % rendimiento -100 P2-----------------------------------------------
Donde:
P1: Peso en gramos de las hojas frescas.
P2: Peso en gramos del aceite esencial obtenido.
Control de calidad: a) Control organoléptico y fisicoquímico: se evaluaron el sabor, olor, color, aspecto, pH, índice de refracción y densidad en el aceite esencial.
Géneros de bacterias gram negativas: Proteus spp., y Enterobacter spp., Cepas bacterianas: 1. Gram negativas: cepas ATCC 25922 de Escherichia coli, ATCC 27853 de Pseudomonas aeruginosa y ATCC 700603 de Klebsiella pneumoniae. 2. Gram positivas: cepas ATCC 25923 de Staphylococcus aureus y ATCC 29212 de Enterococcus faecalis.
Preparación del inóculo: los inóculos bacterianos fueron preparados con base en lo recomendado por el Instituto de Estándares Clínicos y de Laboratorio (CLSI)12; por ello, entre tres a cuatro colonias se tomaron y suspendieron en disolución salina estéril, contenidas en tubos de ensayo hasta alcanzar una equivalencia en turbidez de 0,5 a escala de Mac Farland 1,5 x 108 UFC/ml.
Preparación de las muestras y los controles: para alcanzar concentraciones del 100%, 75% y 50%, el extracto fue diluido con agua destilada y el aceite esencial con dimetilsulfóxido. Los controles positivos se diluyeron con agua destilada hasta concentraciones de 5 mg/ml para la ciprofloxacina, 30 mg/ml para la doxiciclina y la amoxicilina respectivamente. A continuación, se crearon grupos, incluyendo el Grupo 1 para 100% de extracto, el Grupo 2 para 75% de extracto, el Grupo 3 para 50% de extracto, el Grupo 4 para 100% de aceite esencial, el Grupo 5 para 75% de aceite esencial, el Grupo 6 para 50% de aceite esencial, el Grupo 7 para ciprofloxacina 5 mg/ml, el Grupo 8 para doxiciclina 30 mg/ml, el Grupo 9 para amoxicilina 30 mg/ml y el Grupo 10 para agua destilada (control negativo).
Según el método de pozos en agar Kirby-Bauer modificado descrito en el libro “Research in Plants of Medical Importance”13, la actividad antibacteriana se determinó sembrando con un hisopo estéril embebido en el inóculo bacteriano en agar Müller Hinton y dejándolo secar durante cinco minutos. A continuación, se hicieron pozos de 6 mm de diámetro en el agar con un sacabocados estéril de 6 mm, en los cuales se depositó 50 μl de cada una de las muestras, procedimiento realizado por triplicado para validad los resultados. Después, las placas de Petri se incubaron invertidas durante 24 horas a 37 °C en una estufa. Tras medir el diámetro de inhibición, se compararon con la escala de sensibilidad de Duraffourd 14: diámetro menos de 8 mm nula (-), entre ≥ de 8 mm y menos de 14 mm sensible (+), muy sensible (++) entre ≥ de 14 y menos de 20 mm y ≥ de 20 mm extremadamente sensible (+++).
Análisis estadístico: Los datos fueron recolectados mediante la técnica de revisión documentada, en una planilla elaborada en la que se incluyeron variables necesarias, para la realización del trabajo. Los datos fueron analizados en el programa estadístico SPSS versión 25, mediante el cual se calculó, describió y comparo las variables de estudio. Asimismo, se realizó la prueba de contraste de normalidad de Shapiro-Wilk y la prueba estadística ANOVA de un factor de Kruskal-Wallis para variables con distribución no normal y la prueba de Tukey para variable con distribución normal, con el fin de comparar medias entre 3 o más grupos, con una significancia estadística de p<0,05, al 95% de confianza.
Análisis estadístico: se recogieron los datos a través de la técnica de revisión documentada e incorporaron a una hoja de cálculo elaborada. Se utilizó la herramienta estadística SPSS versión 25 para analizar, calcular y comparar las variables del estudio. Asimismo, se utilizó la prueba de normalidad de Shapiro-Wilk, para variables normales el ANOVA de Tukey y Kruskal-Wallis para variables no normales, para comparar medias entre tres o más grupos con una significación estadística de 0,05, al 95% de confianza.
Resultados
De las hojas de muña se obtuvo un aceite esencial de color ligeramente amarillo, aspecto oleoso, olor mentolado y sabor picante. Los parámetros fisicoquímicos fueron: densidad de 0,9075 g/ml, pH de 5,0 e índice de refracción de 1,4766 y 1,19% fue el rendimiento porcentual del aceite esencial obtenido (Tabla 1).
Tabla 1. Aminoácidos activos identificados en los modelos y longitud de interacciones (Angstrom, Å).
Fuente: Elaboración propia.
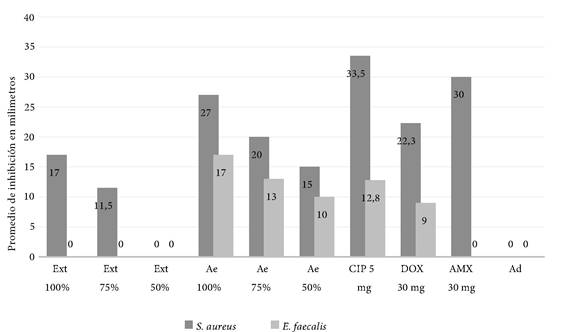
Según la escala de sensibilidad de Duraffourd, los mayores diámetros de inhibición contra el crecimiento del Staphylococcus aureus fue para el aceite esencial al 100%, la amoxicilina y la ciprofloxacina con diámetros de 27 mm, 33,3 mm y 33,5 mm respectivamente. Además, el aceite al 100% demostró diámetros de inhibición muy sensibles de 17 mm contra el crecimiento del E. faecalis (Figura 1).
Fuente: elaboración propia.
Nota. Ext: Extracto, Ae: Aceite esencial, CIP: Ciprofloxacina, DOX: Doxiciclina, AMX: Amoxicilina, Ad: agua destilada.
Figura 1. Medias de los diámetros de inhibición de las bacterias Gram positivas.
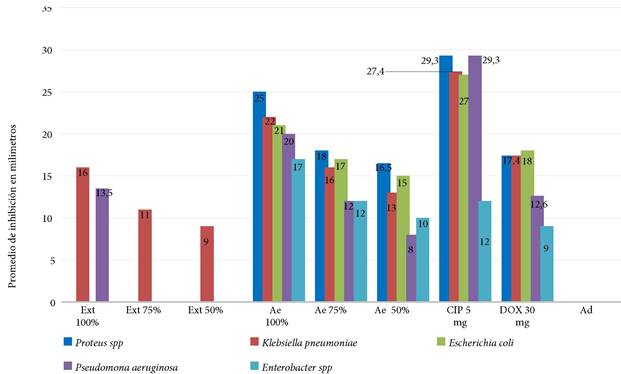
El aceite esencial al 100% y la ciprofloxacina, presentaron mayores diámetros de inhibición contra el crecimiento del Proteus spp., K. pneumoniae, E. coli y P. aeruginosa, los cuales fueron mayores a 20 mm, resultados sumamente sensibles (+++) respecto a la escala sensibilidad de Duraffourd. Por otro lado, el aceite al 100% con 17 mm resultado sensible (++) del diámetro de inhibición frente al desarrollo del Enterobacter spp., fue más efectivo en comparación con los 12 mm de diámetro de inhibición de la ciprofloxacina y los 9 mm de la doxiciclina (Figura 2).
Fuente: elaboración propia.
Nota. Ext: Extracto, Ae: Aceite esencial, CIP: Ciprofloxacina, DOX: Doxiciclina, Ad: agua destilada.
Figura 2. Medias de los diámetros de inhibición de bacterias Gram negativas.
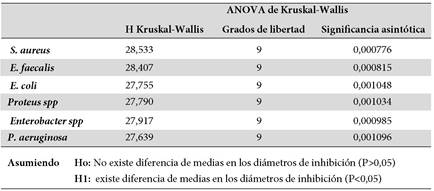
La prueba Shapiro-Wilk de los diámetros de inhibición del extracto, el aceite esencial, los controles positivos y el control negativo frente al crecimiento de la E. coli, el E. faecalis, la P. aeruginosa, el Enterobacter spp., el Proteus spp., y el S. aureus reportaron valores de p<0,05 por lo que la variable de interés no cuenta con distribución normal. Empero, los diámetros de inhibición siguen una distribución normal para la K. pneumoniae, ya que su p valor fue mayor a 0,05.
Según, el p valor del ANOVA de un factor de Tukey el cual fue (p= 5,8757E-13) de los diámetros de inhibición frente al crecimiento de la K. pneumoniae (Tabla 2); y los valores de p de Kruskal-Wallis de los diámetros de inhibición contra al crecimiento de la E. coli, E. faecalis, P aeruginosa, Enterobacter spp., Proteus spp., y S. aureus los cuales fueron menores a 0,05 (Tabla 3); para muestras independiente se observó diferencia significativa en los diámetros de inhibición en al menos dos de los 10 grupos analizados según, el análisis del p valor del ANOVA de un factor de Tukey el cual fue (p= 5,8757E-13) (Tabla 2). Por ello, la hipótesis nula fue rechazada y la hipótesis alternativa aceptada; argumentando que si existe diferencia significativa entre las medias de los diámetros de inhibición.
Tabla 2. ANOVA de Tukey del diámetro de inhibición contra la Klebsiella pneumoniae
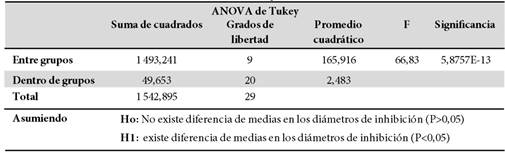
Fuente: Programa estadístico SPSS versión 25, según la base de datos.
Discusión
El color, olor, sabor, aspecto, densidad e índice de refracción del aceite reportados por Olivera15, y Torrenegra16 fueron semejantes a los obtenidos: por otro lado, Gonzales17 y Sánchez et al.18, reportaron densidades de 0,886 g/ml y 1,032 g/ml respectivamente, resultados contrarios al estudio la cual fue 0,9075 g/ml.
El rendimiento porcentual del aceite esencial en los trabajos de Olivera15, Laura11, Ambuludi19 y Torrenegra16, osciló entre 0,25% a 0,93%; rendimiento distinto a los obtenidos, pero equivalente al porcentaje descrito por Peña1 que fue mayor al 1,0%.
En el estudio realizado por Paucar6, la doxiciclina y el aceite esencial de muña mostraron una actividad antibacteriana comparable contra Staphylococcus aureus, con resultados comparables a los obtenidos al no demostrar una diferencia estadísticamente significativa. Sin embargo, es importante señalar que los halos de inhibición de nuestro estudio fueron mayores.
Según la investigación de Peña y Gutiérrez1, no hubo diferencias apreciables entre la actividad antibacteriana de la amoxicilina y el aceite esencial en su concentración más alta frente a Staphylococcus aureus y Klebsiella pneumoniae, arrojando resultados comparables a los obtenidos.
En el estudio de Castaeda et al20, la actividad antibacteriana del aceite esencial al 100% y al 50% frente a Enterococcus faecalis fue menor; resultado opuesto al obtenido y comparable con el de Borda, que informó para el aceite esencial una mayor actividad antibacteriana.
La ciprofloxacina control positivo utilizado en el estudio de Olivera15 contra el crecimiento de la Escherichia coli fue más efectiva que el aceite esencial frente a la Pseudomonas aeruginosa; resultados opuestos a los obtenidos, donde la actividad antibacteriana frente a estas bacterias tanto para la ciprofloxacina como para el aceite esencial no mostraron una diferencia significativa.
Conclusiones
En comparación con el extracto, el aceite esencial mostró una mayor actividad antibacteriana.
El aceite esencial presentó promedio de diametros de inhibición superiores a los de la doxiciclina y la amoxicilina frente a cepas de Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y Proteus spp. Sin embargo, no superaron los diámetros de inhibición de la ciprofloxacina.
En comparación con la ciprofloxacina, la doxiciclina y la amoxicilina, el aceite esencial al 100% fue más eficaz para impedir el crecimiento del Enterococcus faecalis y el Enterobacter spp.