El pie diabético se caracteriza por ser una condición infecciosa, ulcerosa o daño en el tejido profundo del pie, acompañado de anomalías neurológicas y grados diversos de enfermedad vascular periférica en las extremidades inferiores1. La infección de pie diabético además de afectar la calidad de vida del paciente, tiene consecuencias sociales y altos costos para la salud pública2
Las ulceras de pie diabético son complicaciones frecuentes de la diabetes mellitus3. Según estudios epidemiológicos el riesgo de desarrollar una ulcera en el pie es de 2,5% por año4, su prevalencia en Europa varía entre 19 y 34 %; mientras que, en Latinoamérica es de 20 % en diabéticos internados5. La prevalencia de amputación puede variar de 1% en países europeos, hasta un 15 % en el África y países en vías de desarrollo6.
Los microorganismos aislados con mayor frecuencia de un pie diabético infectado son las bacterias Gram positivas de las cuales predomina el Staphylococcus aureus, seguido por las Pseudomonas aeruginosa y las Enterobacterias7.
El tratamiento farmacológico con antibióticos se enfoca en la cicatrización, precaución de infecciones secundarias y evitar la amputación8. Empero, las bacterias involucradas, el uso previo de antibióticos, la gravedad de la infección y la conducta del paciente son factores que influyen en la terapia9. Asimismo, el tratamiento puede fracasar por el desarrollo de resistencia bacteriana, un problema en aumento por el uso inadecuado de antibióticos10.
En relación con lo anterior, la resistencia antibiótica es más frecuente en pacientes con enfermedad arterial periférica, cuyos cambios en el lecho vascular periférico genera hipoxia tisular que reduce la concentración de antibiótico en el sitio de infección, aumenta el periodo de uso del tratamiento y favorece la aparición de bacterias resistentes11.
Por las consideraciones previas, el objetivo de investigación fue evaluar la evolución de la resistencia a los antibióticos de los microorganismos aislados de pie diabético infectado en pacientes atendidos en el Hospital Clínico Viedma, en las gestiones 2014, 2016, 2018 y 2021.
Materiales y métodos
Investigación observacional, descriptiva, retrospectiva, transversal con enfoque cuantitativo, el universo de estudio estuvo conformado por 344 cultivos y antibiogramas de pacientes con diagnóstico de pie diabético infectado atendidos en el Hospital Clínico Viedma, en las gestiones 2014, 2016, 2018 y 2021. Se utilizó un método de muestreo no probabilístico por conveniencia.
Se incluyeron cultivos y antibiogramas de muestras de exudados y secreciones tomadas de ulceras, abscesos y heridas de pie derecho o izquierdo. Fueron excluidas muestras sin estudios bacteriológicos, cultivos negativos o contaminados. Las variables de estudio fueron: número de microorganismos aislados, bacterias identificadas, resistencia a los antibióticos y los mecanismos de resistencia antibiótica.
La sensibilidad y resistencia antibiótica fueron determinadas por el método de difusión en agar; de acuerdo con, recomendaciones del Clinical and Laboratory Standards Institute [CLSI]12. En bacterias Gram positivas se probaron discos de antibióticos de oxacilina, ciprofloxacina, clindamicina, eritromicina, gentamicina, sulfatrimetroprin y vancomicina. En enterobacterias amoxicilina-clavulánico, cefalotina, cefuroxima, ceftazidima, ceftriaxona, cefepime, imipenem, ciprofloxacina, aztreonam, sulfatrimetoprim y gentamicina. A los bacilos gramnegativos no fermentadores se les incorporó ampicilina- sulbactam, piperacilina-tazobactam, meropenem y colistina.
La producción de betalactamasas de espectro ampliado (BLEA), se evidenció por resistencia a aminopencilinas, cefalosporinas de 1ra generación e inhibidores de betalactamasas; las betalactamasas de espectro extendido (BLEE) por resistencia a cefalosporinas de 1ra, 2da, 3ra y 4ta generación mediante sinergia y confirmación con doble disco. Las BLEE son enzimas que se caracterizan por proporcionar resistencia a penicilinas y cefalosporinas, incluyendo las de tercera y cuarta generación.
Los resultados fueron recolectados en un formulario que contenía las variables requeridas para el desarrollo del presente estudio. El análisis estadístico de las variables se llevó a cabo utilizando el software estadístico SPSS versión 25. Se calcularon frecuencias, porcentajes para la descripción y comparación de las variables.
Resultados
De un universo de 344 cultivos y antibiogramas analizados, 268 cumplieron los criterios de inclusión y exclusión, siendo esta la muestra analizada en el software estadístico SPSS versión 25, para un nivel de confianza del 95 % y 2,82 % de error máximo permitido.
Número de microrganismo aislado por cultivo, de 227 cultivos analizados se aislaron un solo microorganismo, 76 microorganismos se aislaron de 38 cultivos (dos por cultivo) y nueve microorganismos fueron aislados de tres cultivos (tres por cultivo), haciendo un total de 312 microorganismos aislados de los 268 cultivos positivos analizados (Tabla 1).
Tabla 1. Frecuencia de microorganismos aislados de los cultivos positivos analizados, por gestión
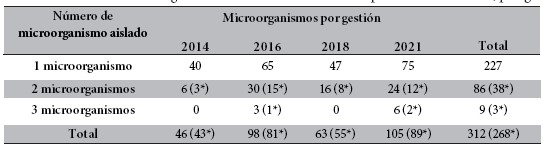
Nota: *número de cultivos analizados.
Fuente: Elaboración propia, según base de datos.
Los microorganismos aislados con mayor frecuencia fueron las bacterias Gram negativas con 71,5 % (n=223), de las cuales la Klebsiella spp con 17,95 % (n=56), la Escherichia coli con 17,63 % (n=55) y el Proteus spp 15,38% (n=48) fueron enterobacterias predominantes; mientras que, la Pseudomona spp con 6,41 % (n=20) y el Acinetobacter spp con 2,88 % (n=9) fueron bacilos Gram negativos no fermentadores más frecuentemente aislados. Con respecto de las bacterias Gram positivas el Staphylococcus aureus fue el más frecuente aislado con 16,34 % (n=51) (Tabla 2).
Tabla 2. Frecuencia y porcentaje de microorganismos aislados e identificados en cultivos positivos, por gestión.
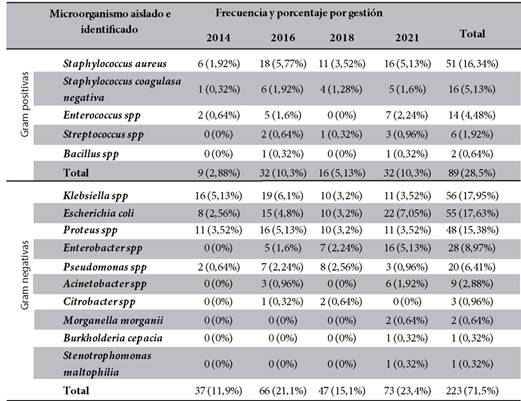
Fuente: Elaboración propia, según base de datos.
La resistencia a la meticilina del Staphylococcus aureus (MRSA) de 17 % en 2014 y 2016, aumento a 18% en 2018 y a un 25% en 2021 respectivamente (Figura 1).
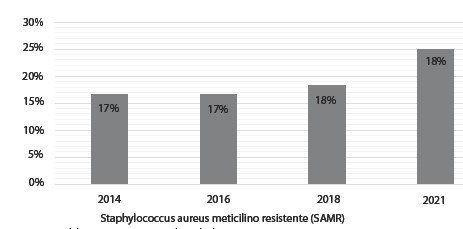
Fuente: Elaboración propia, según base de datos
Figura 1. Porcentaje de Staphylococcus aureus meticilino resistente (SAMR), por gestión.
La resistencia de la Klebsiella spp a la ciprofloxacina aumento de 31,25 % en 2014 a 45,4 % en 2021, respecto al sulfatrimetoprim la resistencia incremento de 37,5 % en 2014 a 54,4 % en 2021 y la resistencia a la gentamicina de 18,7% en 2014 aumento a 45,4% en 2021. En relación con, la Escherichia coli la resistencia a la ciprofloxacina y al sulfatrimetoprim de 37,5 % en 2014 aumento a 63,6 % en 2021 respectivamente; mientras que, la resistencia a la gentamicina de 25% en 2014 se incrementó a 40,1 % en 2021 (Tabla 3).
Tabla 3. Porcentaje de resistencia a los antibióticos de la Klebsiella spp y Escherichia coli enterobacterias más frecuentemente aisladas, por gestión.
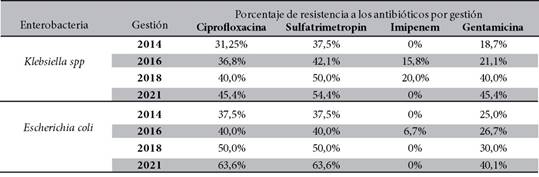
La Klebsiella spp productora de betalactamasas de espectro extendido (BLEE) de 37,5% en 2014 aumentó a 42,1% en 2016, y de un 50 % en 2018 incrementó a 54,5 % en 2021. La Escherichia coli productora de BLEE de 25 % en 2014 aumentaron a 40% en 2016, y de un 50 % en 2018 aumento a 63,6 % en 2021 (Figura 2).

Fuente: Elaboración propia, según base de datos
Figura 2. Porcentaje de Klebsiella spp y Escherichia coli que produjeron Betalactamasas de Espectro Extendido (BLEE), por gestión
Los bacilos gramnegativos no fermentadores como la Pseudomona spp presento un aumento de resistencia del 0% a la ceftazidima, cefepime, aztreonam y ciprofloxacina en 2014 y 2016 aun 12,5 % a la ceftazidima, cefepime y aztreonam y aun 25% a la ciprofloxacina en 2018 e incrementando hasta un 33,3 % a la ceftazidima, cefepime, aztreonam y ciprofloxacina en 2021, la resistencia a los carbapenémicos de un 0 % en 2014, 2016 y 2018 acrecentó al 33,3 % en 2021.
Mientras que la resistencia del Acinetobacter spp aumento de un 0 % en 2016 a un 33,3 % a la piperacilina-tazobactam, aztreonam y al 66,7 % a la ampicilina-sulbactam, de igual manera este bacilo incrementó su resistencia de un 33,3 % en 2016, hasta un 50 % a la ceftazidima, cefepime, ciprofloxacina, imipenem y meropenem en 2021 (Tabla 4).
Tabla 4. Porcentaje de resistencia a los antibióticos de las Pseudomonas spp y Acinetobacter spp bacilos gramnegativos no fermentadores más frecuentemente aislados, por gestión.
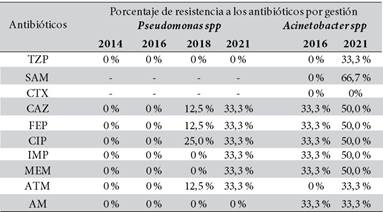
TZP: Piperacilina-Tazobactam, SAM: Ampicilina-Sulbactam CTX: Cefotaxima, CAZ: Ceftazidima, FEP: Cefepime, CIP: Ciprofloxacina, IMP: Imipenem, MEM: Meropenem, ATM: Aztreonam, AM: Amikacina.
Fuente: Elaboración propia, según la base de datos.
Discusión
En el presente estudio los microorganismos que más se aislaron fueron las bacterias Gram negativas, resultado semejantes a los obtenidos por los estudios de Carro et al13. en Buenos Aires, Argentina en 2018, González y Pérez14 en Nicaragua en 2020 y Pagno et al15. realizado en Argentina en 2022.
La bacteria Gram negativa aislada con mayor frecuencia en este estudio fue la Klebsiella spp; resultado idéntico al reportado en los trabajos de Ceballos y Zamora16 en Ecuador en 2019 y Solórzano et al.17 en 2020 en Machala, Ecuador; sin embargo, diferente al descrito en investigaciones de Neyra et al.18 en Lima-Perú en 2017, Chinchilla et al.19 en Zacapa, Guatemala en 2020 y Rosario M20, en Chiclayo-Perú en 2021 en las cuales la Escherichia coli fue mayormente aislada.
Se observó un aumento de resistencia a la ciprofloxacina, sulfatrimetoprim y gentamicina por parte de la Escherichia coli y Klebsiella spp, hallazgos similares a los obtenidos en los estudios de Carro et al.13 en Buenos Aires, Argentina en 2018 y Solórzano et al.17 en 2020 en Machala, Ecuador.
El porcentaje de enterobacterias productoras de betalactamasas de espectro extendido fue idéntico al reportado por Yovera et al.21 en Lima-Perú en 2017.
La bacteria Gram positiva predominante fue el Staphylococcus aureus, resultado opuesto al obtenido, Cascante et al22, en Costa Rica en 2021 en los cuales el Enterococcus faecalis fue el más frecuente. El porcentaje de Staphylococcus aureus meticilino resistente fue relativamente bajo, en comparación a los estudios de Neyra et al.18 en Lima-Perú en 2017, Febles et al.23 en 2020 en Cuba, cuyo resultado fue 3 veces mayor.
Con base en las consideraciones anteriores concluimos que, las bacterias Gram negativas predominaron, siendo la Klebsiella spp la enterobacteria más frecuente, cuya resistencia a la ciprofloxacina, sulfatrimetoprim y gentamicina se incrementó considerablemente durante los años de estudio.
La Pseudomona spp y el Acinetobacter spp fueron bacilos Gram negativos no termentadores más aislados con un notable aumento de la resistencia a la ciprofloxacina, cefalosp orinas y carbapenémicos. Así mismo, se observó un incremento de Staphylococcus aureus meticilino resistente (SAMR).















