Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista Boliviana de Física
versión On-line ISSN 1562-3823
Revista Boliviana de Física vol.42 no.42 La Paz nov. 2023
https://doi.org/10.53287/amax5385mv75o
A.ARTÍCULOS
Un estudio experimental de
propiedades físicas de saponinas
y su interacción con un modelo
de membrana de Bacterias
Gram-negativas empleando
películas Langmuir-Blodgett
y Microscopía de Fuerza Atómica
An experimental study of the physical
properties of saponins and their
interaction with gram negative bacterial
membrane models using Langmuir-Blodgett
techniques and atomic forcé microscopy
Cesar Mauricio Cornejo Mejía1![]() , Armando Ticona1
, Armando Ticona1![]() , Giovanna Almanza2
, Giovanna Almanza2![]()
Cristhian Carrasco3![]() ,Flavio Ghezzi1
,Flavio Ghezzi1![]()
1 Instituto de Investigaciones Físicas (IIF), Universidad Mayor de San
Andrés (UMSA), La Paz, Bolivia. cmcmfsk@gmail.com
2 Instituto de Investigaciones Químicas (IIQ), Universidad Mayor de San
Andrés (UMSA), La Paz, Bolivia.
3 Instituto de Investigación y Desarrollo de Procesos Químicos (IDEPROQ), Universidad
Mayor de San Andrés (UMSA), La Paz, Bolivia.
Recibido: 20 de agosto de 2023 Aceptado: 27 de noviembre de 2023
Resumen
Las saponinas son biotensoactivos no iónicos que presentan propiedades antifúngicas, antivirales y antibacterianas. Sin embargo, no se conoce en buena medida los mecanismos por los que las saponinas presentan estas propiedades. En el presente trabajo se emplearon las técnicas de Langmuir y microscopía de fuerza atómica (AFM) para investigar las interacciones de saponinas con un modelo de membranas de Bacterias Gram-negativa. Las películas de lípidos contenían extractos de fosfatidiletanolamina y fosfatidilglicerol de la bacteria Escheri-chia coli. Los resultados sugieren que las saponinas repelen a los fosfolípidos, lo que aumenta la fluidez de la membrana. También mostraron evidencia de adsorción de las saponinas por el modelo de membrana. Estos resultados se cotejaron con imágenes AFM. Se propone un mecanismo de la forma en que la saponina altera la membrana fosfolípica. La técnica Langmuir y la microscopía de fuerza atómica resultaron ser herramientas útiles para investigar la interacción de compuestos biológicamente relevantes con modelos de membrana celular. Los resultados de las mediciones de presión superficial, combinado con los obtenidos de AFM, nos dieron evidencia sobre la susceptibilidad de las membranas a la inserción de saponinas y sus posibles modos de acción. Los resultados de este estudio pueden contribuir a una mejor comprensión de los mecanismos de actividad antifúngica, antiviral y antibacteriana de las saponinas.
Palabras clave: Monocapas de Langmuir-Blodgett - saponinas - fosfolípidos - microscopía de fuerza atómica
Abstract
Saponins are non-ionic biosurfactants that exhibit antifungal, antiviral and antibacterial properties. However, the mechanisms by which saponins exhibits these properties are not well understood. In the present work, Langmuir and atomic forcé microscopy (AFM) tech-niques were employed to investígate the interactions of saponins with a model of Gram-negative bacterial membranes. The lipid films contained extracts of phosphatidylethanola-mine and phosphatidylglycerol from Escherichia coli bacteria. The results suggest that saponins repel phospholipids, thereby increasing membrane fluidity. They also showed evidence of adsorption of the saponin by the membrane model. These results were cross-checked with AFM images. A mechanism for how saponin alters the phospholipid membrane is proposed. Langmuir technique and atomic forcé microscopy proved to be useful tools to investígate the interaction of biologically relevant compounds with cell membrane models. The results of the surface pressure measurements, combined with those obtained from AFM, provided evidence for the susceptibility of membranes to the insertion of saponins and their possible modes of action. The results of this study may contribute to a better understanding of the mechanisms of antifungal, antiviral and antibacterial activity of saponins.
Subject headings: Langmuir-Blodgett monolayers - saponins - phospholipids - atomic forcé microscopy
1 Introducción
Las saponinas son biotensoactivos, glucósidos de esteroides o de triterpenoides no iónicos, que se pueden encontrar en diversidad de plantas y animales. Estructuralmente presentan características anfifílicas generadas a partir de sitios lipófilos (soluble en lípidos) e hidrófilos (soluble en agua). A pesar de la gran variedad de estructuras químicas, la característica común de todas las saponinas es la presencia de al menos un enlace glucósido que une una parte de aglicona (esteroide o triterpenoide) con una parte de glicona (mono u oligosacárido). Su capacidad para formar espumas estables en soluciones acuosas, es la razón por la cual se las ha denominado saponinas (del latín sapo, jabón). Si bien el papel biológico de las saponinas aún se desconoce en gran medida, existen estudios que han demostrado su importancia en el campo de la biología y la medicina. Las plantas, en respuesta a la amenaza de agentes patógenos, producen y almacenan saponinas en partes que son susceptibles al ataque de depredadores ( Osbourn, [1996], Szakiel et al., [2011]), debido a que estos compuestos tienen propiedades antifúngicas, antivirales y antibacterianas ( Fuchs et al., [2009], Podolak et al., [2010]). Han mostrado actividad citotóxica en las líneas celulares de cáncer como leucemia, melanoma, SNC, pulmón no microcítico, colon, ovario, mama, renal y próstata, por lo que hoy en día se las utiliza en la terapia contra el cáncer ( Fuchs et al., [2009], Podolak et al., [2010]). También se conoce que en las células tumorales pueden actuar de forma extracelular o intracelular, y para fines del presente estudio interesa poner énfasis en la primera, que se refiere a la inhibición directa de proteínas de membrana o el cambio de la permeabilidad de la membrana.
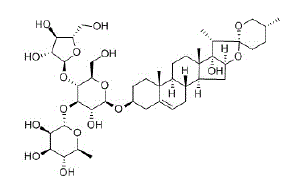
Fig. 1: Representación de la saponina Chonglou II, en la cual se observa un elemento soluble en lípidos (el esteroide o el triterpenoide) y un elemento soluble en agua (el azúcar).
La actividad de las saponinas triterpenoides y esteroides en la membrana se ha asociado a su capacidad para interactuar con el colesterol unido a la membrana ( Keukens et al., [1996]). Las observaciones de Ransom ( Podolak et al., [2010]) y Windaus ( Windaus, [1909]), plantean que las saponinas simplemente eliminan el colesterol de las membranas biológicas ( Böttger & Melzig, [2013]), dejando los poros permeables al citosol. Los trabajos de Schulman y Rideal ( Schulman & Rideal, [1937a]; Schulman & Rideal, [1937b]), así como observaciones en microscopía electrónica de membranas celulares biológicas tratadas con saponina ( Bangham & Horne, [1962], Glauert et al., [1962]) son consistentes con la hipótesis de la penetración de saponinas en las capas lipídicas y la alteración de estas ( Lin & Wang, [2010]). Por otro lado, algunos trabajos sugieren que el colesterol no es crucial para las saponinas con la membrana celular ( Hu et al., [1996]) o su actividad de membrana está relacionada a las interacciones con receptores específicos ( Siu et al., [2008]). Por tanto, el conocimiento del mecanismo a nivel molecular es escaso, aún no se ha logrado describir de manera sistemática las fuerzas de interacción entre diferentes saponinas y fosfolípidos. Parte de la información preliminar puede deducirse de la investigación de dinámica molecular (DM) ( Lin & Wang, [2010]).
Una de las especies que ha resultado ser interesante para el estudio de saponinas es la quinua, en ésta se han encontrado al menos 87 tipos de saponinas triterpenicas ( Madl et al., [2006], Lozano et al., [2012]). La quinua (Chenopodium quinoa Willd.) es una hierba anual de la familia Amaranthaceae que presenta una amplia variabilidad. Se la cultiva principalmente en la cordillera de los Andes, porque produce un pseudocereal con alto valor nutricional, siendo la quinua real una de las variedades más importantes. En los últimos años, Bolivia se ha situado como uno de los mayores productores de quinua del mundo y el principal productor de quinua real ( Furche et al., [2015]). Esto, junto con las propiedades antifúngicas, antivirales y antibacterianas de las saponinas posiciona a Bolivia en la posibilidad del desarrollo de nuevos biopesticidas o nuevos antibióticos, a fin de dar valor agregado a los residuos de quinua en el país.
En los últimos años, las monocapas lipídicas de Langmuir se usaron ampliamente para investigar las interacciones de modelos de membrana con compuestos biológicos activos. La tecnología Langmuir-Blodgett se basa en las propiedades particulares de moléculas orgánicas como lípidos, fosfolípidos o glicolípidos para orientarse en una interfaz aire/agua, entre la fase gaseosa ( Wenda et al., [2017]) y la líquida para minimizar su energía libre y formar una monocapa llamada película de Langmuir. Los materiales clásicos que forman las monocapas Langmuir son compuestos con dos regiones moleculares distintas: un grupo de cabeza hidrófilo que es fácilmente soluble en agua y una cola hidrófoba que es soluble en disolventes no polares. Cuando se aplican gotas de una solución diluida de una molécula anfifílica en un disolvente volátil y no miscible en agua, como el cloroformo, sobre una superficie de agua pura o alguna subfase, las moléculas se extienden rápidamente sobre la interfaz para cubrir toda el área disponible.
Después de la evaporación del disolvente, la película interfacial da como resultado una capa monomolecular, con los grupos de cabeza sumergidos en el agua y los grupos de cola que quedan fuera (apuntando hacia la fase de gas). Esta orientación específica está dictada por la naturaleza anfifílica de las moléculas ( Girard-Egrot & Blum, [2007]).
La microscopía de fuerza atómica (AFM), es un tipo de microscopía con sonda de barrido con una resolución demostrada del orden de fracciones de un nanómetro, más de 1000 veces mejor que la difracción óptica límite. La información se recopila al tocar la superficie con una sonda mecánica. Los elementos piezoeléctricos que facilitan movimientos pequeños pero precisos y el comando (electrónico) permiten una exploración precisa. Lo que resulta ideal en el estudio de las membranas celulares y las moléculas biológicamente activas. El AFM, también es muy útil para la caracterización a nivel de topografía, dureza, adhesión, medidas in situ, entre otros, permite la resolución de problemas estructurales y la caracterización mecánica de proteínas, detectar el funcionamiento de proteínas (como el desplegamiento de proteínas) y manipular proteínas individuales ( Atwood et al., [2013]).
El objetivo del presente estudio es analizar la interacción del concentrado de saponinas de quinua real boliviana con un modelo de membrana de lípidos compuesto de L-α-fosfatidiletanolamina, L-α-fosfatidilglicerol y 1,2-Dipalmitoil-sn-glicero-3-fosfo-rac-(1-glicerol), empleando películas Langmuir-Blodgett y microscopía de fuerza atómica. La composición de estos lípidos refleja, en cierta medida, el contenido de lípidos de la membrana interna de bacterias Gram-negativas ( Dowhan, [1997]) cargados negativamente, extraídos de la bacteria Escherichia coli.
Fig. 2: a) Estructura de L-α-fosfatidiletanolamina (Escherichia coli) (POPE), b) L-α-fosfatidilglicerol (POPG).
2 Materiales y métodos
2.1 Materiales, reactivos y preparación de la mezcla de lípidos
Fig. 3: Espectro de masas del concentrado de saponinas de quinua real boliviana obtenida en un espectrómetro de masas tipo Orbitrap ( Madl et al., [2006]).
El concentrado de saponina utilizado en este estudio fue elaborado por el Instituto de Investigaciones Químicas de la Universidad Mayor de San Andrés, a partir de los residuos de quinua real del altiplano boliviano ( Madl et al., [2006]). Para caracterizar este compuesto natural se obtuvo el espectro de masas, utilizando un espectrómetro de masas tipo Orbitrap de la marca Thermo Scientific. Las soluciones de concentrado de saponina se las preparó usando agua Milli-Q.
Los lípidos que se utilizaron para el modelo de membrana fueron:
• L-α-fosfatidiletanolamina (Escherichia coli) sal de sodio ( > 99 % pureza) (para futuras referencias POPE), con un masa molar de 718 g/mol ( Wenda et al., [2017], Bogdanov et al., [2010]), ver figura 2,
• L-α-fosfatidilglicerol (Escherichia coli) sal de sodio ( > 99 % pureza) (para futuras referencias POPG), con una masa molar de 771 g/mol ( Bogdanov et al., [2010]), ver la figura 2,
• 1,2-Dipalmitoil-sn-glicero-3-fosfo-rac-(1-glicerol) sal de sodio ( > 99 % pureza) (para futuras referencias DPPG), con una masa molar de 745 g/mol,
provenientes de AvantiPolar Lipids.
Los fosfolípidos POPE y POPG se disolvieron en cloroformo con una concentración final de 1.2 mg/ml ( Wenda et al., [2017]) y DPPG se disolvió en cloroformo/metanol/agua (65:35:8 v/v) con una concentración final de 1.12 mg/ml, con el fin de obtener la solución de lípidos utilizamos POPE/POPG/DPPG (8:1.5:0.5 v/v) con una concentración final de la mezcla 1.2 mg/ml. Se utilizó cloroformo al 98.5 % y metanol al 99.8 %, ambos solventes de procedencia Avantor performance material Poland S.A. (POCH S.A.). La capa de lípidos fue preparada en una interfaz aire/tampón fosfato salino (para futuras referencias PBS), con cloruro de potasio (KCl puro), fosfato hidrogenado disódico (Na2HPO4 puro), hidrógeno fosfato de sodio dihidratado (NaH2PO4 2H2O puro). Estos últimos tres compuestos de procedencia POCH S.A., además de cloruro de sodio (NaCl) de procedencia Chempure S.A, toda la solución a una concentración final de 0.01 M. En todos los experimentos se utilizó agua ultrapura Milli-Q con una resistividad final de 18.2 MΩ.
2.2 Isotermas de compresión y medidas de la cinética de adsorción
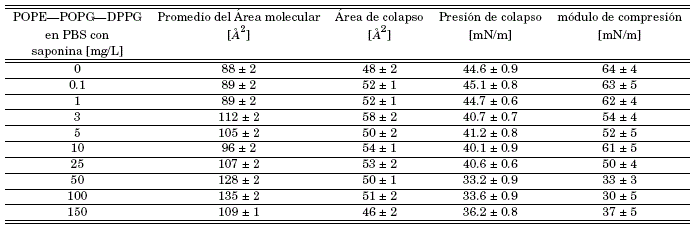
Table 1: Usando la técnica Langmuir obtenemos los valores característicos para las monocapas de POPE - POPG - DPPG en subfase PBS 0.01 M (ph 7.4) y subfase PBS con saponina a (0.1, 1.0, 3, 10, 25, 50, 100, 150) mg/L, datos necesarios para la caracterización de la membrana y su interacción con la saponina.
La capa de lípidos fue preparada en una interface aire/PBS usando un equipo KSV NIMA L-LB (Biolin scientific) equipado con 2 barreras hidrofílicas en un canal de teflón de 130 ml de volumen. La presión superficial fue monitoreada con un papel filtro que cumplía la función de plato de Wilhelmy. La capa lipídica se preparó sobre la fase líquida PBS con un pH de 7.4 a 0.001 M. Para el monitoreo de las isotermas de compresión se esparció la mezcla de lípidos sobre la fase líquida y se aguardó un lapso de 10 a 15 minutos a que el solvente (cloroformo) se evapore. Se registró el cambio de la presión superficial con respecto al área de las moléculas, para esto se comprimieron las barreras hidrofílicas a una velocidad constante de 10 mm/min a temperatura constante de 22.5 °C, se realizaron 3 medidas de todas las isotermas para realizar la correspondiente estadística. La resolución del equipo para las isotermas de compresión fue, ± 0.02 Å2 en el área molecular y ± 0.004 mN/m en la presión superficial. Se registraron las isotermas con concentraciones de 0.1, 1, 3, 5, 10, 25, 50, 100, 150 mg/L de saponina en la subfase PBS.
Los experimentos de absorción se realizaron en un canal de teflón de 40 ml de volumen en la misma subfase líquida PBS. Esparciendo la mezcla de lípidos en la fase líquida con una jeringa Hamilton y comprimiendo las barreras hidrofílicas se obtuvieron diferentes presiones superficiales. Inmediatamente alcanzada la presión superficial deseada, se inyectó saponina en la fase líquida, de tal manera que se obtuvo la concentración de saponina deseada en la subfase y se registró la variación de la presión superficial en función del tiempo. Todos los experimentos se los realizó en KSV NIMA L-LB (Biolin scientific) a una temperatura de 22.5 °C. Se registró la evolución temporal de la membrana para las presiones iniciales de 5, 10, 20, 25, y 30 mN/m a una concentración de 10 mg/L en la subfase. Por otra parte, se registró la evolución temporal de la membrana para dos presiones iniciales constantes 10 y 15 mN/m, con diferentes concentraciones de saponina en la subfase: 5, 10, 25, 50 mg/L para una presión inicial de 10 mN/m y 5, 10, 50 mg/L para una presión inicial de 15 mN/m.
2.3 Imágenes AFM
Se depositaron pequeñas vesículas unilaminares del lípido en una placa de mica que funcionó como base para tomar las imágenes en el AFM (SUVs)( Barenholz et al., [1977]). Primero se preparó soluciones stock de mezcla de los lípidos POPE/POPG/DPPG, con una relación molar de 8:1.5:0.5 (v/v) a una concentración final de 1 mg/ml. Asumiendo que se usaría 200 microlitros de POPE, se calcularon los volúmenes necesarios para los otros dos lípidos. La mezcla de lípidos fue puesta en un par de tubos de ensayo y se la expuso a agitación bajo un flujo de gas Argón, con la finalidad de que los solvente se evaporarán.
Se mantuvo la mezcla en estas condiciones hasta que se formó una torta de lípidos en la parte inferior de los tubos. Posteriormente se expusieron los tubos de ensayo a un desecador al vacío durante una hora para que los solventes y residuos terminen de eliminarse.
Se añadió 5 ml de PBS a 0.01 M para que los lípidos se rehidraten, posteriormente las muestras se las puso en un baño sonicador por una hora a 37°C, con el fin de obtener una muestra homogénea y clara. Esta muestra se la diluyó 5 veces en PBS.
Paralelamente se prepararon los substratos de mica limpiándolos con cinta adhesiva especial, de tal manera, que una de las caras quedó completamente limpia. Estos sustratos de mica se los dejó expuestos, por el lado limpio, a la dilución de PBS con las SUVs durante 3 días (lo recomendado es dejarlas por lo menos 12 horas) obteniendo las películas de lípidos por difusión de SUVs. Finalmente se removió los sustratos de mica, los cuales estaban listos para la toma de imágenes en AFM.
3 Resultados y Discusión
El espectro de masas del concentrado de saponina, ver figura 3, revela que el peso molecular de la molécula con mayor abundancia es 993.4 uma. Para la medición del espectro, el equipo añade un protón a la muestra para ionizarla, por lo que se debe restar una unidad de masa atómica al valor obtenido para la molécula con mayor abundancia, quedando entonces 992.4 uma. Este valor cae en el rango de masas de la familia de las saponinas ( Madl et al., [2006]). Las demás moléculas son despreciables por su abundancia respecto a la saponina. Otra tarea prioritaria fue ver la solubilidad del concentrado de saponina en algunos solventes tales como cloroformo, etanol, metanol y agua. Resultando negativa para las primeras, lo que impidió evaluar el comportamiento de películas formadas por solo saponina.
3.1 Mediciones de presión superficial
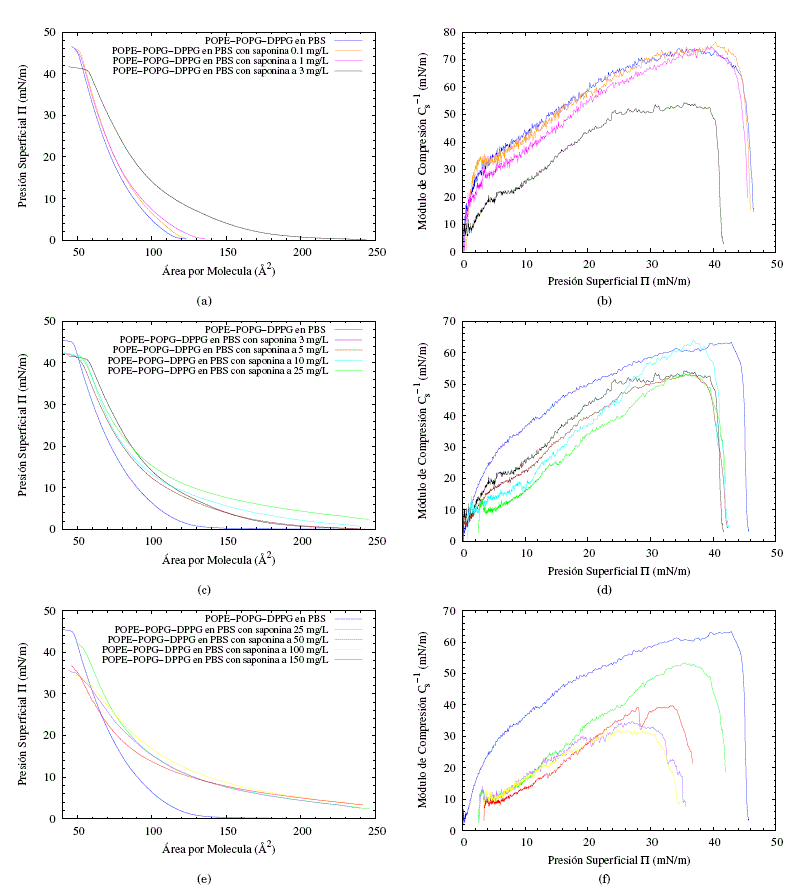
Las películas lipídicas comprimidas en la interfaz aire/PBS se consideran modelos útiles para estudiar las interacciones entre los lípidos y la variedad de compuestos, incluidas las proteínas, los péptidos y las drogas ( Maget-Dana, [1999]). En el presente trabajo se utilizó un enfoque similar para investigar la influencia de las saponinas en la capa formada por POPE/POPG/DPPG. Con el fin de evaluar la afinidad del concentrado de saponina con la monocapa POPE/POPG/DPPG se realizaron experimentos donde los cambios de presión superficial de la película lipídica se controlaron durante la compresión en una subfase PBS de 0.01 M que contenía varias concentraciones de saponina, como se muestra en las figuras 4(a), 4(c) y 4(e), la presencia de saponina en la subfase causa un desplazamiento de las isotermas hacia valores más altos de área molecular. Esto demuestra que las saponinas se incorporan a la película interfacial durante su formación. Los parámetros característicos de las monocapas formadas en la subfase que contiene saponinas se muestran en la Tabla 1. Por su parte las figuras 4(b), 4(d) y 4(f) nos muestran los módulos de compresión, Cs-1, para cada isoterma calculados a partir de:

donde ∏ es la presión superficial y A el área por molécula.
Los parámetros característicos de la monocapa en la subfase PBS y subfase PBS en disolución a varias concentraciones de saponina, se las puede ver en la tabla (1). Para un mejor análisis se separaron los resultados en 3 grupos importantes bajo el criterio de dos saltos evidentes en punto de colapso entre la concentración de 1 a 3 y 25 a 50 mg/L. Como consecuencia se obtuvo la siguiente clasificación: en las figuras 4(a) y 4(b) las concentraciones de 0.1, 1, y 3 mg/L, en las figuras 4(c) y 4(d) las concentraciones de 3, 5, 10 y 25 mg/L y en las figuras 4(e) y 4(f) las concentraciones de 25, 50, 100 y 150 mg/L. Para cada grupo se añadió la monocapa en subfase PBS pura.
Es evidente que el desplazamiento de las isotermas depende de la concentración del concentrado de saponina. Es decir, el área por molécula aumenta cuando aumenta la concentración de saponina en la subfase. En la figura 4(a) se pueden observar los resultados obtenidos para la interacción de bajas concentraciones de saponina (0.1, 1, 3 mg/L) con la monocapa. Los resultados muestran que no existen diferencias considerables entre las soluciones con baja concentración de saponina y la subfase de PBS puro, lo que sugiere que a estas concentraciones la saponina no está afectando de manera significativa en el ordenamiento de la monocapa. También es importante destacar que la presión de colapso para la mayoría de las monocapas de la figura 4(a) casi no ha cambiado, lo que indica que la estabilidad de las películas en la interface no se vería afectada por la presencia de saponinas a estas concentraciones. De igual manera, el módulo de compresión figura 4(b) no presenta cambios significativos para concentraciones por debajo de 3 mg/L en comparación con la membrana en subfase PBS pura. Lo que sugiere que a concentraciones menores a 3 mg/L la monocapa casi no interactúa con la membrana. En síntesis, los parámetros característicos (tabla 1) de las monocapas formadas en la subfase que contenía saponina a concentraciones menores de 3 mg/L, no presentan variaciones significativas con respecto a la subfase PBS puro, siendo el intervalo 1 a 3 mg/L un salto en las interacciones de la membrana y la saponina.
Fig. 4: Ilustraciones obtenidas de las isotermas de compresión (figuras (a), (c) y (e)) y su respectivos módulos de compresión (figuras (b), (d) y (f)) para tres grupos de concentraciones de saponina en la subfase.
Al incrementar la concentración de saponina se encontró un nuevo conjunto de isotermas, en las que el punto de colapso difiere significativamente en comparación con la subfase de PBS puro, pero no entre los puntos de colapso de este grupo. Es así que se puede reconocer una caída abrupta del punto de colapso de la monocapa entre una solución PBS con saponina de concentración 1 mg/L a una concentración y 3 mg/L (figura 4(a) y 4(c)). A su vez las isotermas se desplazan dependiendo del incremento de la concentración, indicando la no afinidad de la saponina con la monocapa, esto sugiere que la influencia de la saponina cada vez es más dramática aumentando la fluidez de la monocapa, lo que concuerda con la disminución significativa del módulo de compresión (figura 4(d)), lo que sugiere que la monocapa pasa de un estado líquido condensado a un estado líquido expandido. En consecuencia, la caída de la presión superficial en el punto de colapso y el desplazamiento de las isotermas muestran que no hay una buena penetración de la saponina en la monocapa.
Con el propósito de explorar aún más el comportamiento de la monocapa en función de la concentración, incrementamos nuevamente la concentración de saponina en la subfase PBS, obteniendo un nuevo grupo de concentraciones en las que el punto de colapso varía de forma significativa con el punto de colapso de la monocapa en subfase PBS pura. Pero, curiosamente, el punto de colapso no varía entre el grupo. De lo cual se puede reconocer una caída abrupta del punto de colapso de la monocapa entre una solución PBS con saponina de concentración 25 mg/L a una concentración de 50 mg/L (figuras 4(c) y 4(e)). Los desplazamientos y los módulos de compresión (figura 4(f)) de las isotermas para estas concentraciones no difieren mucho, lo que muestra que se llega una repulsión máxima de la monocapa hacia las saponinas.
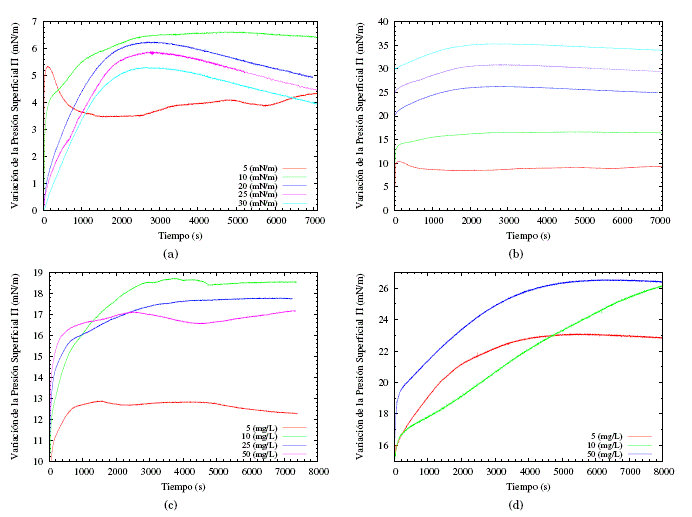
El análisis de los módulos de compresión máximos, junto con los cambios en el área molecular en presencia de saponinas disueltas en la subfase PBS, lleva a la conclusión de que las monocapas de POPE/POPG/DPPG no tienen buena afinidad con la saponina y no acomodan en su mayoría a las moléculas de saponina en la formación de la membrana. Esto sugiere que también se pueden esperar diferencias significativas cuando se considera la inserción espontánea de estas saponinas en la película lipídica. Con el fin de verificar esta suposición, se investigaron las interacciones de la monocapa de lípidos con la saponina disuelta e inyectada espontáneamente en la subfase, con el fin de estudiar las cinéticas de adsorción. Primero, se extendió una solución lipídica en la interfaz aire/PBS para obtener varias presiones superficiales iniciales y se inyectó pequeños volúmenes de la solución de saponina concentrada en la subfase de PBS. Los resultados se ilustran en las figuras 5(a) y 5(b). Por otra parte, se realizaron experimentos a presión constante, pero variando la concentración de la saponina en la subfase PBS.
En las figuras 5(a) y 5(b) se puede observar que la evolución temporal de la presión superficial comienza al mismo tiempo que la inyección del concentrado de saponina en la subfase. Para estos experimentos la concentración final de saponina en la subfase fue de 10 mg/L. La figura 5(a) muestra cómo las presiones superficiales se incrementan en un rango de entre 6.5 y 5 mN/m, independiente de la presión inicial de los experimentos, aunque el sistema debería tender a una presión de absorción de equilibrio. Este sistema presenta un incremento relativamente bajo de la presión superficial en un tiempo muy similar (entre 2000 y 3000 segundos) para todas las presiones iniciales, a excepción de las presiones iniciales de 5 y 10 mN/m, que presentan un relativo equilibrio en el tiempo. Cabe resaltar que luego de alcanzar el máximo de incremento de presión superficial estas tienden a disminuir. Los resultados indican que el incremento de presión superficial es debido a la saponina, la cual forma una capa en la interface monocapa y subfase, por tanto, es muy probable que una vez se haya alcanzado este punto las saponinas colapsen la membrana. Esto se puede explicar bajo la hipótesis de que en este intervalo de tiempo, la monocapa adsorbe los triptenos o esteroides lipófilos de la saponina (soluble en grasas), ya que la parte hidrófila (glucósido) está interactuando con la subfase PBS. Sin embargo, la saponina no se disocia en la subfase, porque son tensoactivos no iónicos. La parte lipófila se adsorbe en la membrana e interactúa con la parte hidrofilia, teniendo como consecuencia alteraciones en la membrana. Estos resultados muestran un posible mecanismo por el cual las saponinas presentan actividad biológica.
Con base en las observaciones, se tomaron dos presiones iniciales (10 y 15 mN/m) constantes y se estudió el cambio de la presión superficial en el tiempo en función de las diferentes concentraciones (figuras 5(c) y 5(d)). Se pudo evidenciar que hay un incremento de entre 6 a 8 mN/m para concentraciones entre 10 y 50 mg/L, sugiriendo que este incremento es independiente de la concentración de saponinas en la subfase. El incremento para una concentración de 5 mg/L es del orden de 3 mN/m, lo que no representa un cambio significativo respecto a la presión inicial. Sucede un caso parecido para una presión inicial de 15 mN/m sugiriendo que el incremento es independiente de la concentración de la saponina en la subfase.
3.2 Estudios de Microscopía de Fuerza Atómica
La microscopía de fuerza atómica (AFM) se empleó para investigar las interacciones de las saponinas con la bicapa de POPE/POPG/DPPG con una relación molar de 8:1.5:0.5 (v/v) a una concentración final de 1 mg/ml. Los resultados más representativos se los muestra en la figura 6. la primera fila nos muestra las 4 placas de mica con la bicapa depositada sobre ella sin exponer a saponina (muestra blanca). Se tomaron varias secuencias de imágenes de las placas con la bicapa, expuestas a diferentes concentraciones de saponina (10, 25, 50 mg/L). Cabe mencionar que las imágenes se tomaron inmediatamente se expuso la placa a las diferentes concentraciones de saponina. Para la concentración más elevada 50 mg/L, se tomaron imágenes de la placa con la bicapa inmediatamente expuesta a la saponina y posteriormente a la placa expuesta durante toda una noche. La segunda fila de la figura 6, ilustra la evolución temporal de la bicapa interactuando con una concentración de 50 mg/L de saponina inmediatamente se la expuso a esta. La tercera fila, por su parte, muestra la bicapa expuesta toda la noche a la concentración de 50 mg/L de saponina.
Fig. 5: En (a) y (b) se muestra el incremento de la presión superficial a diferente presiones iniciales de la membrana lipídica, inyectando una disolución de saponina en la subfase PBS, de tal manera que la concentración final de la subfase será 10 mg/L. (c) muestra el incremento de la presión superficial a diferentes concentraciones de saponina en la subfase PBS para una presión superficial inicial de 10 mN/m. (d) muestra el incremento de la presión superficial a diferentes concentraciones de saponina en la subfase PBS para una presión superficial inicial de 15 mN/m.
Fig. 6: Secuencia de imágenes en el tiempo de una bicapa lipídica (primera fila) y su interacción con saponina a 50 mg/L de concentración (segunda y tercera fila). Obsérvese que los círculos rojos en las imágenes muestran los cambios en la topografía del sistema. La escala de color varía de 0 a más o menos 10 nanómetros, las imágenes tiene un área de 5 x 5 micrómetros.
Las imágenes AFM de bicapas resultantes muestran dominios separados (figuras 6), que corresponden a regiones topográficamente más bajas y más altas. Estos pueden atribuirse a la presencia de una fase desordenada líquida (Lα) y una fase gel (Lβ), respectivamente. Los extractos de POPE y POPG, proveniente de la bacteria Escherichia coli utilizados en este trabajo, son mezclas de lípidos de donde la separación de fases es un fenómeno esperado. El análisis de las imágenes obtenidas para las series sin exposición a saponina reveló que el grosor medio de la fase Lα y la fase Lβ es de 3.1 ± 0.6 nm y 5.1 ± 0.4 nm, respectivamente, lo que concuerda con la literatura ( Konarzewska et al., [2017]). Curiosamente la exposición de la bicapa a concentraciones de 10 y 25 mg/L no muestran cambios significativos en la topografía de la bicapa, a excepción de pequeñas reducciones en la fase gel, y aparición de pequeñas micelas en los lugares de la placa de mica donde no se logró difundir la bicapa lipídica.
Por otra parte, la segunda fila de imágenes de la figura 6 nos muestra la bicapa depositada en mica expuesta a saponina con una concentración de 50 mg/L. Esta serie de imágenes fueron tomadas inmediatamente después de la exposición. A priori, es evidente que existen cambios del área en la fase gel, además de la aparición de micelas (puntos de color blanco salen de la escala de la imagen en degradé de color). Estas mismas características se evidenciaron en las muestras expuestas a menores concentraciones para un tiempo cero de la fase Lα y la fase Lβ, las cuales tenían un espesor de 2.2 ± 0.8 nm y 6.2 ± 0.9 nm, respectivamente, y 190 minutos después no se registra un cambio significativo en el espesor de las fases.
La tercera fila de la figura 6, muestra los resultados más representativos de las secuencias de imágenes tomadas en AFM. A simple vista se puede observar la aparición de una nueva fase, un desorden de la fase Lβ. Para un tiempo cero, la fase Lα y la fase Lβ, presentan un espesor de 3.8 ± 0.6 nm y 6.0 ± 0.3 nm, respectivamente, mientras que para el minuto 195 la fase Lα y la fase Lβ presentan un espesor de 2.1 ± 0.8 nm y 6.1 ± 0.4 nm, respectivamente. Nótese que entre estas dos fases aparece un nuevo valor representativo en la gráfica de distribución de valores de los datos que se coteja, de buena manera, con la imagen a simple vista, en ésta se ve una nueva fase con un espesor de 4.8 ± 0.7 nm. Lo que apoya la propuesta de que las saponinas, en primer lugar, son repelidas por la bicapa y posteriormente el tripteno o la parte lipófila es la que interactúa con los fosfolípidos del modelo de membrana. Esta última interacción se traduce en una alteración de la membrana.
4 Conclusiones
El valor del peso molecular medido en el espectrómetro de masas, nos da 992.4 uma, como el componente con la mayor abundancia en el concentrado de saponinas provenientes de la quinua boliviana. A partir de esta medida y en base a la literatura ( Madl et al., [2006]), podemos afirmar que el componente de mayor abundancia pertenece a la familia de saponinas, ya que este grupo de moléculas tiene un rango de masas atómicas entre 600 a 1200 uma. Las pruebas de solubilidad del concentrado de saponina en diferentes solventes nos dieron resultados negativos, por lo cual no se pudo investigar en el sistema Langmuir, la formación de monocapas de la saponina en sí misma.
Los parámetros característicos de la monocapa en subfase PBS y subfase PBS en disolución a varias concentraciones de saponina se las puede ver en la tabla (1). Es evidente que el desplazamiento de las isotermas depende de la concentración de saponina. Es decir, el área por molécula aumenta cuando aumenta la concentración de saponina en la subfase como muestra la figura 4. El análisis de los módulos de compresión máximos, junto con los cambios en el área molecular en presencia de saponinas disueltas en la subfase PBS, lleva a la conclusión de que las monocapas de POPE/POPG/DPPG no tienen buena afinidad con la saponina y no acomodan, en su mayoría, a las moléculas de saponina en la formación de la membrana.
En este contexto, los estudios de la cinética de adsorción, mostraron que el sistema no cuenta con una presión de adsorción de equilibrio. Al inyectar espontáneamente saponina en la subfase el sistema simplemente presenta un incremento relativamente bajo. Interesantemente, luego de alcanzar el máximo de incremento de presión superficial, estas tienden a disminuir. Según los resultados obtenidos, se puede indicar que el incremento de presión superficial es debido a la formación de una capa por la saponina en la interface monocapa y subfase, por tanto, es muy probable que una vez que se haya alcanzado o se esté alcanzando este punto, las saponinas colapsen la membrana. Esto se puede explicar bajo la hipótesis de que en este intervalo de tiempo la monocapa adsorbe los triptenos o esteroides lipófilos de la saponina (soluble en grasas) ya que la parte hidrófila (glucósido) está interactuando con la subfase PBS. Sin embargo, la saponina no se disocia en la subfase, porque son tensoactivos no iónicos. La parte lipófila se adsorbe en la membrana e interactúa con la parte hidrófila, teniendo como consecuencia alteraciones en la membrana. Estos resultados muestran un posible mecanismo por el cual las saponinas presentan actividad biológica.
Por su parte, los estudios de AFM nos muestran la aparición de una nueva fase entre la fase líquida y gel, estos últimos son típicos de estos sistemas. Esta nueva fase se la puede atribuir a un aumento en la fluidez de la fase. Para un tiempo cero de exposición a saponina, la fase Lα y la fase Lβ presentan un espesor de 3.8 ± 0.6 nm y 6.0 ± 0.3 nm, respectivamente, mientras que para el minuto 195, la fase Lα y la fase Lβ presentan un espesor de 2.1 ± 0.8 nm y 6.1 ± 0.4 nm, respectivamente, se observa una nueva fase de un espesor de 4.8 ± 0.7 nm. Lo que apoya la propuesta de que las saponinas en primer lugar son repelidas por la bicapa y posteriormente el tripteno o la parte lipófila es la que interactúa con los fosfolípidos del modelo de membrana. Esta última interacción se traduce en una alteración de la membrana a la membrana.
AGRADECIMIENTOS
Se agradece al Professor Slawomir Sek y su grupo de la Faculty of Chemistry, Biological and Chemical Research Institute, University of Warsaw, Polonia, por el apoyo brindado durante el desarrollo de los experimentos.
Conflicto de intereses Los autores declaran que no existe conflicto de intereses respecto a la publicación de este documento.
References
Atwood, S., Choi, Y., & Leonenko, Z. 2013, Int. J. Mol. Sci., 14, 3514 [ Links ] Arial, Helvetica, sans-serif">[Bangham & Horne 1962]
Bangham, A. & Horne, R. 1962, Nature, 196, 952 [ Links ] Arial, Helvetica, sans-serif">[Barenholz et al. 1977]
Barenholz, Y., Gibbes, D., Litman, B., Goll, J., Thompson, T., & Carlson, R. 1977, Biochemistry, 16, 2806 [ Links ] Arial, Helvetica, sans-serif">[Bogdanov et al. 2010]
Bogdanov, M., Heacock, P., Guan, Z., & Dowhan, W. 2010, Proc Natl Acad Sci U S A, 107(34), 15057 [ Links ] Arial, Helvetica, sans-serif">[Böttger & Melzig 2013]
Böttger, S. & Melzig, M. 2013, Bioorg. Med. Chem., 21, 7118 [ Links ] Arial, Helvetica, sans-serif">[Dowhan 1997]
Dowhan, W. 1997, Annu. Rev. Biochem., 66, 199 [ Links ] Arial, Helvetica, sans-serif">[Dubreil et al. 2003]
Dubreil, L., Vie, V., Beaufils, S., Marion, D., & Renault, A. 2003, Biophys. J., 85, 2650 [ Links ] Arial, Helvetica, sans-serif">[Francis et al. 2002]
Francis, G., Kerem, Z., Makkar, H., & Becker, K. 2002, Br. J. Nutr., 88, 587 [ Links ] Arial, Helvetica, sans-serif">[Fuchs et al. 2009]
Fuchs, H., Bachran, D., Panjideh, H., Schellmann, N., Weng, A., Melzig, M., Sutherland, M., & Bachran, C. 2009, Curr. Drug Targets, 10, 140 [ Links ] Arial, Helvetica, sans-serif">[Furche et al. 2015]
Furche, C., Salcedo, S., Krivonos, E., Rabczuk, P., Jara, B., Fernandez, D., & Correa, F. International Quinoa Trade, ed. . C. N. D. Bazile, D. Bertero (FAO CIRAD), 316-329 [ Links ]
Girard-Egrot, A. & Blum, L. Langmuir-Blodgett Technique for Synthesis of Biomimetic Lipid Membranes., ed. D. Martin (Springer, Boston, MA), 23-74 [ Links ]
Glauert, A., Dingle, J., & Lucy, J. 1962, Nature, 196, 953 [ Links ]
Hu, M., Konoki, K., & Tachibana, K. 1996, Biochim. Biophys. Acta, Lipids Lipid Metab., 1299, 252 [ Links ]
Keukens, E., Vrije, T. D., Jansen, L., Boer, H. D., Janssen, M., Kroon, A. D., Jongen, W., & Kruijff, B. D. 1996, Biochim. Biophys. Acta Biomembr., 1279, 243 [ Links ]
Konarzewska, D., Juhaniewicz, J., Guzeloglu, A., & Sek, S. 2017, Biochim. Biophys. Acta, Biomembr., 1859, 475 [ Links ]
Lin, F. & Wang, R. 2010, J. Mol. Model., 16, 107 [ Links ]
Lozano, M., Ticona, E., Carrasco, C., Flores, Y., & Almanza, G. 2012, Rev. Boliviana de Química, 29(2), 131 [ Links ]
Madl, T., Sterk, H., Mittelback, M., & Rochberger, G. 2006, J. Am. Soc. Mass Spectrom, 17, 795 [ Links ]
Maget-Dana, R. 1999, Biochim. Biophys. Acta, Biomembr., 1462, 109 [ Links ]
Osbourn, A. 1996, Trends Plant Sci., 1, 4 [ Links ]
Podolak, I., Galanty, A., & Sobolewska, D. 2010, Phytochem. Rev., 9, 425 [ Links ]
Schulman, J. & Rideal, E. 1937a, Proc. R. Soc. Lond. Ser. B Biol. Sci., 122, 29 [ Links ]
-. 1937b, Proc. R. Soc. Lond. Ser. B Biol. Sci., 122, 46 [ Links ]
Siu, F., Ma, D., Cheung, Y., Lok, C., Yan, K., Yang, Z., Yang, M., Xu, S., Ko, B., He, Q., & Che, C. 2008, Proteomics, 8, 3105 [ Links ]
Szakiel, A., Pažczkowski, C., & Henry, M. 2011, Phytochem. Rev., 10, 493 [ Links ]
Wenda, J., Juhaniewicz, J., Tymecka, D., Konarzewska, D., & Sek, S. 2017, Langmuir, 33, 4619 [ Links ]
Windaus, A. 1909, Ber. Dtsch. Chem. Ges., 42, 238 [ Links ]
APÉNDICE
A. SOBRE LOS PARÁMETROS CARACTERÍSTICOS DE LASMONOCAPAS
A partir de las isotermas se determinaron todos los parámetros característicos de la monocapas Lang-muir. El punto de colapso se obtuvo, delimitando la región de la isoterma donde esta presenta una "rodilla" que es la región en la que la monocapa colapsa. A partir de esta región, se busca una recta que pase por la menor cantidad de puntos de la región (no menor a 10 puntos). La parte media de esta recta definirá el punto de colapso. El promedio del área molecular se obtuvo, tomando la intersección de una recta con el eje x, de tal forma que esta recta tenga la mayor cantidad de puntos sobre sí y que inicie muy próximo al punto de colapso. Para determinar el módulo de compresión, se realizó una derivada numérica de los datos, posteriormente se les aplico un suavizado exponencial con un factor a = 0.9. A partir de la curva suavizada se obtiene el máximo del módulo de compresión proyectando el valor máximo de la curva sobre el eje y.
B. SOBRE LAS IMÁGENES AFM
Para el procesamiento de las imágenes AFM se utilizó el software libre Gwyddion. El espesor de la bicapa se determinó a partir de la distribución de alturas en cada imagen, se determinaron los picos de mayor repetición como los espesores de las fases a estudiar. Para el cálculo del error se tomó el ancho de la distribución de alturas. Aproximadamente a 2/3 partes a partir del valor del ancho de la tabla de distribución de alturas se tomó la mitad de este valor como el error de la media. Primero se procesaron las imágenes de las muestras blancas sin exposición a saponina, posteriormente las imágenes de bicapa expuesta a saponina (para esta última se estudiaron las fotos a intervalos de tiempo de entre 15 y 20 minutos).