INTRODUCCIÓN
La leucemia aguda neonatal (LAN), también conocida como leucemia del recién nacido o leucemia congénita, es una neoplasia maligna rara en el recién nacido. Se presenta durante las cuatro primeras semanas de vida extrauterina(1),(2) y tiene una frecuencia menor al 1 % de todas las leucemias pediátricas(3),(4), representa aproximadamente 1 por cada millón de recién nacidos vivos (5),(6). Así también, existe un aproximado del 10 % de recién nacidos con Síndrome de Down que desarrollan una forma de leucemia megacarioblástica (leucemia transitoria neonatal), la cual suele desaparecer espontáneamente durante los primeros meses de vida(7); sin embargo, de estos niños con remisión espontánea, un 33 % desarrollarán leucemia megacarioblástica aguda (LMA M7) dentro de los primeros 4 años de vida (8),(9).
Las características biológicas de la leucemia aguda neonatal son diferentes de la leucemia aguda en niños mayores de un año, por lo que conllevan un pronóstico generalmente malo. La LAN se presenta con una amplia gama de signos y síntomas clínicos, la infiltración cutánea leucémica es una característica importante que ocurre en 30% de los casos (10); consecutivamente, la hepatoesplenomegalia es de hallazgo común, la adenopatía es menos frecuente. Asítambién, pueden presentar compromiso del sistema nervioso central (SNC) o hemorragia intracraneal secundaria a trombocitopenia (6).
Las características laboratoriales albergan un recuento elevado de glóbulos blancos (>100.000/ul) con presencia de células inmaduras(11),(12), las alteraciones cromosómicas se presentan en la región 11q23 en 50 %, con translocaciones (4;11) y (11;19)(13),(14). Los tipos de leucemia más representativos son la leucemia mieloide aguda (LMA) que conlleva la mayoría de los casos (64%), seguida de la leucemia linfoblástica aguda (LLA) (36%)(15). Dentro de la LMA, los subtipos mielomonoblástica (LMA M4) y monoblástica (LMA M5) son más comúnmente reportados, y en menor frecuencia la megacarioblástica (LMA M7) (12),(16). Respecto de la LLA, estas presentan inmunofenotipo de estirpe pro B (CD10 negativo(17),(18) y co-expresión de marcadores mieloides como el CD65 (15). La leucemia transitoria en el recién nacido con Síndrome de Down, por su parte, está asociada con una morbilidad significativa((12) y progresión a LMA M7 implicando mayor morbimortalidad (9),(19).
El origen de LAN se suscita en el útero (leucemogénesis uterina), hecho que está respaldado por una presencia de alta carga tumoral (blastos) al nacer según reportes de leucemia en niños nacidos muertos, así como, reportes de presencia de anomalías cariotípicas idénticas en gemelos monocigóticos (6). Asimismo, se ha explorado múltiples factores potenciales que involucran la exposición de los padres a sustancias nocivas del ambiente laboral, asociaciones significativas con el consumo materno de alcohol, mala calidad del aire (20),(21) y exposición a herbicidas agrícolas durante el embarazo (22)-(26).
Es así que, el presente estudio epidemiológico sobre la leucemia aguda neonatal pretende identificar las características representativas y las regiones de nuestro país con mayor incidencia de LAN, esto con el propósito de promover el estudio sobre los factores de riesgo asociados.
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo retrospectivo que consideró a neonatos (dentro de las 4 primeras semanas de vida) con leucemia neonatal, pacientes provenientes de diferentes regiones de Bolivia diagnosticados entre las gestiones 2007 a 2023. El diagnóstico laboratorial, a solicitud y en coordinación con los médicos tratantes, fue realizado en la Unidad de Biología Celular de la Facultad de Medicina-UMSA, Bolivia, mediante estudios morfológicos e inmunofenotípicos, así como, estudios biomoleculares en algunos casos. Tales estudios fueron realizados a partir de muestras de sangre venosa periférica (SVP) y/o médula ósea (MO) obtenidas en tubos vacutainer con EDTA.
El estudio morfológico fue realizado mediante protocolo institucional empleando tinción May-Grundwald Giemsa. El estudio de immunofenotipo se realizó en las poblaciones de blastos mediante técnica de citométría de flujo panel de ocho colores (FACSCanto II, BD Biosciences, San José, CA, EE. UU.) de acuerdo con protocolos recomendados por Euroflow(27),(28).
Se revisó los datos de hemograma, características morfológicas e immunofenotípicas, y resultados de laboratorio correspondientes al momento del diagnóstico. Consecuentemente, se recolectó datos epidemiológicos concernientes a características clínicas como edad, sexo, seguimiento y radicatoria de la madre durante la gestación.
Se utilizó Microsoft Excel, R y Python de código libre para los análisis estadísticos.
RESULTADOS
Se observó que, desde noviembre de 2007 hasta noviembre de 2023, un total de 13 casos fueron diagnosticados con leucemia aguda neonatal; de estos, 4 casos correspondieron a los dos últimos años (2022 y 2023). La edad media neonatal fue 20 días de vida. La incidencia recayó en neonatos de sexo masculino representando 69 % de los casos (n=9), Tabla 1.
Tabla 1. Características clínicas y laboratoriales de neonatos con leucemia

*Presentaron Síndrome de Down como comorbilidad.
Tipos de leucemia neonatal
El tipo de leucemia más frecuentemente observado fue la leucemia mieloide aguda (LMA). De los 13 casos reportados, 9 (69 %) correspondieron a LMA, respectivamente, el subtipo más frecuente fue LMA M7 (n=5 casos), seguidos de la LMA M1 (n=2 casos) y la LMA M2 (n=1 caso). Los 4 restantes correspondieron a la Leucemia Linfoblástica Aguda B (LLA-B). Tabla 1.
Departamento con mayor incidencia
La mayor incidencia de casos diagnosticados concernió al departamento de Santa Cruz (n=7), correspondiendo al 54 % de todos los casos reportados en Bolivia. Sucesivamente, estuvo Cochabamba 23 % (n=3), seguidos de La Paz, Beni y Chuquisaca con un caso cada uno (23 %), Tabla 1.
Se observó una tasa de incidencia del 0,50 por cada 100.000 habitantes pediátricos en Santa Cruz; consiguientemente, 0,36 para Cochabamba, y 0,08 para La Paz. (Tabla 2).
Tabla 2. Correlación de casos diagnosticados y población pediátrica según departamento 2007-2023
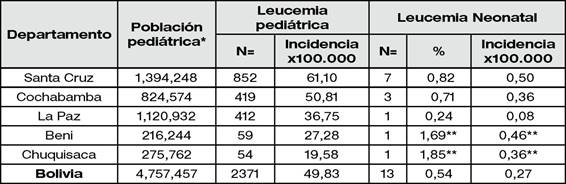
*Población pediátrica <18 años. Los datos de población pediátrica fueron obtenidos del Instituto nacional de Estadística (INE), 2021.
** El número de casos y una menor población pediátrica en esos departamentos dificultan el cálculo de la incidencia, por lo que, los datos correspondientes a esos departamentos no reflejan representatividad.
Características laboratoriales
La leucocitosis fue una condición distintiva (leucocitosis media 106.000/ ul), hemoglobina reflejó una media de 13,2 g/dl y las plaquetas 209.000/ul.
DISCUSIÓN
La leucemia aguda neonatal, una forma rara de leucemia que se presenta entre los primeros 28 días de vida extrauterina, alberga factores etiológicos medioambientales de importante interés. Su incidencia está relacionada con la contaminación del medio ambiente y la exposición de la madre a genotóxicos, durante la gestación, lo que podría advertirse también como un sensor de la calidad del medio ambiente.
La contaminación del aire ha sido clasificada como un carcinógeno humano que incrementa el riesgo de presentar leucemia aguda en niños (29), entre estos la contaminación relacionada con gases de escape de tráfico durante el período de embarazo de la madre (30),(31). En un estudio de metaanálisis, se reportó que el uso de insecticidas en interiores, pero no en exteriores, estaba relacionado con un aumento del 50 % en la leucemia infantil (32); además, este efecto fue más vinculante para la incidencia de LMA que para la LLA durante la exposición en la gestación (33). Otro estudio basado en 8000 casos y casi 15.000 controles mostró una asociación de la LLA (30 % de aumento de riesgo) con la exposición ocupacional paterna antes de la concepción y de la LMA (90 % de aumento de riesgo) con la exposición laboral materna antes del nacimiento del niño (34). También se observó aumento de leucemia aguda neonatal cuando la gestante estuvo expuesta al benceno (35).
Ahora bien, en lo concerniente a nuestro estudio, este tipo de leucemia en Bolivia refleja una tasa de incidencia del 0,27 por cada 100.000 habitantes menores de 18 años y representa el 0,54 % de todas las leucemias pediátricas, dato similar a lo reportado en otros estudios de otros países. Los departamentos con más casos reportados correspondieron principalmente a Santa Cruz seguido por Cochabamba. Santa Cruz muestra una tasa de incidencia del 0,50 por cada 100.000 habitantes pediátricos, con una representatividad del 0,82 % de todas las leucemias pediátricas del departamento. Asimismo, Cochabamba refleja una tasa de incidencia del 0,36 por cada 100.000 habitantes pediátricos representando un 0,71 % dentro de las leucemias pediátricas del departamento. Contrastantemente, el departamento de La Paz refleja una menor tasa de incidencia (0,08 x 100.000) reflejando un porcentaje del 0,24 % de todas las leucemias pediátricas del departamento.
Por otra parte, la leucemia mieloide en el Síndrome de Down se caracteriza por una historia natural distinta y está clasificada por la Organización Mundial de la Salud (OMS) como una entidad distinta, que presenta características clínicas y moleculares únicas(9), su incidencia está relacionada por el incremento de genes relacionados con la megacariopoyesis que se encuentra en el cromosoma 21(9); no obstante es probable que también influyan los factores medio ambientales. En nuestro estudio, del total de casos diagnosticados, 6 estuvieron asociados a Síndrome de Down; de los cuales, 4 correspondieron al subtipo LMA M7 y 2 al subtipo LMA M1.
La indecencia de la leucemia neonatal en Santa Cruz y Cochabamba llama la atención y demanda realizar estudios destinados al establecimiento de los factores de riesgo asociados a la leucemogenésis de la leucemia neonatal. Además, constituye un desafío el identificar potenciales contaminantes del medio ambiente en nuestras regiones.














