Revista CON-CIENCIA
versión impresa ISSN 2310-0265
Rev.Cs.Farm. y Bioq v.8 n.1 La Paz abr. 2020
ARTÍCULOS DE REVISIÓN CIENTÍFICA
Dióxido de cloro, los milagros no existen
Chlorine Dioxide, Miricles Do Not Exist
Cavero Olguin Victor Hugo![]()
ORCID: https://orcid.org/0000-0002-9537-2979
(Instituto de Investigaciones Fármaco - Bioquímicas - UMSA. La Paz - Bolivia)
Fecha de Recepción: 24 Julio 2020 Fecha de Aceptación: 12 Agosto de 2020
Resumen
Objetivos: Contribuir con una revisión bibliográfica acerca de la acción del dióxido de cloro sobre ciertos microorganismos y biomo-léculas. Hacer una revisión de sus usos, toxicidad, reactividad química y bioquímica además de los estudios llevados adelante en modelos animales. Entender cuál es el alcance de los estudios en modelos animales y relacionarlos con la posibilidad de realizar estudios en humanos.
Metodología: Se realizó una revisión exhaustiva sobre el dióxido de cloro. Su uso como antiséptico, toxicidad, estructura molecular, generación de oxígeno molecular, reactividad con biomoléculas y experimentos en modelos animales para entender cuál es el estado del arte de las investigaciones sobre esta molécula. Todas las búsquedas fueron realizadas en bases de datos de artículos científicos así como también por intercambio de información con profesionales entendidos en el tema y curiosidades del colectivo popular.
Resultados: La estructura y reactividad molecular del dióxido de cloro determinan una reactividad alta con ciertos aminoácidos y proteínas, explicando así su actividad biológica inhibitoria. Varios estudios demostraron esta actividad inhibitoria frente a diferentes microorganismos, incluyendo los virus. Tales datos y un ensayo clínico en humanos determinaron una baja toxicidad a bajas concentraciones.
Sin embargo, pese a tales evidencias, la falta de más estudios clínicos en situaciones controladas inviabiliza la posibilidad de extrapolar los datos al ser humano para mitigar enfermedades infecciosas como el Covid-19.
Conclusiones: La reactividad del dióxido de cloro queda clara y su acción sobre las proteínas explica su efectiva acción contra microorganismos como los virus. Su baja toxicidad en estudios llevados adelante en modelos animales abre la posibilidad de más estudios clínicos. Extrapolar los datos que se tienen hasta ahora al ser humano no es correcto.
Palabras Clave
Dióxido de cloro; Covid-19; SARS-CoV-2
Abstract
Objectives: To contribute with a bibliographic review about the action of chlorine dioxide on certain microorganisms and biomolecules. To review its uses, toxicity, chemical and biochemical reactivity besides studies carried out in animal models. To understand what the extent of the studies in animal models is and relate them with the possibility of carrying out studies in humans.
Methodology: An exhaustive review has been done about chlorine dioxide. Its use as an antiseptic, toxicity, molecular structure, molecular oxygen generation, reactivity with biomolecules and experiments on animal models to understand at which state of the art the research on this molecule is. Every search was carried out in data bases of scientific papers as well as by information exchange with professionals of the field and certain curiosities of the popular collective.
Results: The structure and molecular reactivity of chlorine dioxide determines a high reactivity with certain aminoacids and proteins, therefore explaining its inhibitory biological activity. Several studies demonstrated this inhibitory activity against different microorganisms, including viruses. These data and a clinical assay in humans determined a low toxicity at low concentrations. Nonetheless, the lack of more human clinical studies in controlled situations prevents it from the possibility to extrapolate those data to human beings in order to mitigate infectious diseases like Covid-19.
Conclusions: The reactivity of chlorine dioxide remains clarified and its action on proteins explains the effective action against microorganisms like viruses. Its low toxicity in studies carried out in animal models opens the possibility of more clinical studies. Extrapolate data obtained so far to human beings is not correct.
Keywords
Chlorine dioxide; Covid-19; SARS-CoV-2
INTRODUCCIÓN
El dióxido de cloro (ClO2) es un gas a temperatura ambiente de color amarillo verdoso cuyos puntos de fusión y de ebullición son -59 °C y 11 °C, respectivamente. Su solubilidad en agua es de 8 g/L a 20 °C, como productos de su descomposición se tienen los iones clorito (ClO2-) y clorato (ClO3-). Hay tres procedimientos para la obtención de dióxido de cloro: oxidación del clorito de sodio, reducción de clorato y electrólisis de clorito de sodio. Es principalmente utilizado como blanqueador en diferentes campos industriales, también como antiséptico en centros de salud y ambientes diversos.
La crisis sanitaria por la pandemia del Covid-19 ha mostrado, en diferentes niveles, fragilidad en varios sistemas de salud alrededor del mundo. Como bien se ha difundido a nivel mundial la obtención de una vacuna o tratamiento de los que se pueda tener certeza sobre su efectividad toma bastante tiempo, incluyendo que tales fármacos pasen por todas las pruebas de rigor necesarias para salir al mercado y así poder ser aplicados de manera segura a la población. Ante este complejo escenario de indefensión se ha venido promocionando el uso del dióxido de cloro acompañado de toda una campaña y estrategia mediática, llegando a ser descrito con el rótulo de "substancia milagrosa". Sin embargo los reportes que advierten sobre la toxicidad de este compuesto abundan y datan desde hace más de una década atrás. A continuación se describen algunos de los casos más alarmantes que se presentaron por el uso de esta substancia.
La promoción que tiene esta substancia como cura para diversas enfermedades viene desinformando a la sociedad exponiéndola a riesgos documentados. Irresponsablemente promocionada como cura para el autismo, en mayo de 2019 NBC NEWS publicó un reporte sobre el seguimiento que se hizo a este peligroso uso y la distribución de esta substancia ("Parents are poisoning their children with bleach to 'cure' autism. These moms are trying to stop it". NBC News. Retrieved 2019-05-21) link: https://www.nbcnews.com/tech/internet/moms-go-undercover-fight-fake-autism-cures-private-facebook-groups-n1007871). La FDA recomienda no usar este producto y que solo cierto uso en limpieza dental por parte de los profesionales odontólogos puede ser aceptable. Sin embargo la insistente campaña que llevan adelante quienes promocionan esta substancia no escatima recursos para convencer a la población, es así que no conformes con afirmar que cura el autismo, también la ofrecieron como la substancia que cura el VIH/SIDA, el cáncer y otras condiciones clínicas. En agosto de 2019 se reportó más de 16000 casos por envenenamiento debido a la ingesta de esta substancia ("Drinking bleach will not cure cancer or autism, FDAwarns"NBC News. Retrieved 2019-08-12) link: https://www.nbcnews.com/news/us-news/drink-ing-bleach-will-not-cure-cancer-or-autism-fda-warns-n1041636). La promoción de esta substancia data de al menos 20 años atrás y sus conexiones con las pseudociencias y la iglesia Génesis ll fueron también investigadas y documentadas. La FDA se pronunció al respecto y emitió un informe en fecha 12 de agosto de 2019 alertando a la población de los efectos tóxicos del uso de esta substancia (link: https://web.archive.org/web/20190814102219/ https://www.fda.gov/news-events/press-announcements/fda-warns-con-sumers-about-dangerous-and-potentially-life-threating-side-effects-mi-racle-mineral). Sin embargo, pese a que estas referencias son de difusión masiva, parecen no ser totalmente aceptadas por la población.
USO COMO ANTISÉPTICO
El primer uso del dióxido de cloro fue realizado en 1944 para tratar las aguas de las cataratas del Niagara y su uso en el tratamiento de aguas debido a su eficacia fue más popularizado desde 1975. Su empleo como blanqueador fue poco a poco investigado para ser entendido de forma más precisa, estudios que mostraron su reactividad con la materia orgánica en desechos industriales fueron reportándose en la década de 1990, así se observó que el dióxido de cloro tiene una gran reactividad con la lignina, compuesto complejo que se encuentra en las plantas. Anteriores reportes habían considerado el efecto contaminante de las substancias cloradas de uso común como el cloro molecular (Cl2) en el tratamiento de aguas residuales, entre otros (W J Masschelem. Chlorine Dioxide Chemistry and Environmental Impact of Oxychlonne Compounds, Ann Arbor Saence, Ann Arbor, MI, 1979, referido en: Burke M. et al. 1995). Debido a su gran reactividad, el ClO2fue considerado para reemplazar el uso de otras substancias cloradas en el tratamiento de desechos orgánicos, siendo la principal ventaja la ausencia de formación de trihalometanos, substancias peligrosas para la salud humana (Noss C. I. et al. 1986; Couri D. et al. 1982), Dada su alta reactividad y su muy baja o ausente toxicidad se vienen haciendo varios estudios en diferentes campos para afianzar su uso seguro. Pruebas de su uso en solución acuosa mostraron gran efectividad frente a diferentes tipos de microorganismos tal como es el caso de la inactivación de adenovirus entérico y calcivirus felino para los que se utilizaron cultivos de líneas celulares (Thurston-Enriquez J. A. et al. 2005). Mostró una actividad antiviral 10 veces superior a la del hipoclorito de sodio sobre virus de la influenza, herpes y adenovirus humanos (Sanekata T. et al. 2010). Su acción sobre oocitos de Cryptosporidum parvum fue estudiada en aguas para consumo humano (Peeters J. E. et al 1989; Korich D. G. et al. 1990) mostrando que aún a concentraciones menores que las usadas para el tratamiento con ozono (O3) el ClO2 redujo significativamente la infectividad de tales aguas. La inactivación de Verrucarin A y ronidin A, dos micotoxinas de potencial uso como armas biológicas, se llevó adelante en diferentes materiales y en solución acuosa, obteniéndose una completa inactivación de las toxinas solo en el segundo caso (Wilson S. C. et al. 2005). Cultivos de lechugas y rábanos fueron regados con ClO2 a bajas concentraciones mostrando que el crecimiento de las plantas no se vio afectado (Carrillo A. et al. 1996). Incluso en el tratamiento de productos farmacéuticos y de cuidado personal mostró ser ventajoso debido que el uso de ClO2 dio una baja en N-Nitro-sodimetilamina, compuesto altamente carcinogénico que se da como producto secundario luego de tratamiento con substancias cloradas (Zhang A. et al. 2014). Por otro lado, concentraciones de 0.1 ppm son recomendadas y aceptadas por la Administración Americana de Seguridad Laboral y Salud (American Occupational Safety and Health Administration) para su uso en ambientes (Ogata N. et al. 2016) donde los seres humanos no corren riesgo alguno. El uso rutinario del dióxido de cloro como antiséptico es practicado en hospitales y en plantas de tratamiento de aguas principalmente.
TOXICIDAD
Varios son los estudios que han reportado efectos tóxicos por ingesta de dióxido de cloro, así también varios son los estudio pendientes para comprender su acción en muchos órganos del ser humano. Las principales vías de intoxicación pueden ser divididas en tres: inhalación, oral y dérmica. Solamente se conoce un caso de muerte por inhalación de vapor de ClO2 (19 ppm) de un trabajador de una planta en un tanque de blanqueamiento (reporte publicado en 1959). Animales de laboratorio sufrieron afecciones en tejido pulmonar luego de experimentos de exposición por vías aéreas a la substancia blanqueadora, además de también haberse observado la muerte de más de uno de ellos, sometidos a tales experimentos. Los efectos sistémicos por inhalación de dióxido de cloro que destacan más son irritación del tracto respiratorio y capacidad pulmonar disminuida. No se conoce caso alguno sobre muerte en humanos causada por ingesta oral, sin embargo los principales efectos incluyen daño en el tracto gastrointestinal, pese a tal daño,
la molécula también puede ser absorbida y causar daño hematológico, principalmente por la formación de metahemoglobina conduciendo a un estado de metahemoglobinemia, mismo que ocasiona falta de oxigenación por deficiente intercambio gaseoso. Además también se podrían considerar posibles daños hepáticos, renales y endocrinos, entre otros; a pesar de que no hay estudios contundentes sobre la toxicidad sobre estos órganos, hay ciertos estudios en modelos animales sobre estos. La exposición dérmica al dióxido de cloro parece ser la menos peligrosa, aunque como en los anteriores casos mencionados, hace falta más estudios puntuales para tener mayor certeza con tal afirmación. Una revisión exhaustiva de la toxicidad del dióxido de cloro puede encontrarse en:Toxicological Profile for Chlorine Dioxide and Chlorite de U.S. department of Health and Human Services Public Health Service Agency for Toxic Substances and Disease Registry de 2004.
Diferentes estudios en animales y cultivos celulares muestran que esta substancia causa daño en diferentes tejidos y células. Se han publicado varios estudios que muestran la toxicidad de la ingesta del dióxido de cloro con el metabolismo del iodo y con su consecuente afectación al funcionamiento normal de la glándula tiroides. Existen evidencias de que el dióxido de cloro, por su alto poder oxidativo, daña la mucosa gástrica así como también ocasiona la producción de compuestos clorados a partir de la materia orgánica de los nutrientes del tracto gastrointestinal, dándose de estas dos formas una absorción defectuosa de iodo y en consecuencia ocasionando el mal-funcionamiento de la glándula tiroides. Estudios en monos verdes africanos mostraron que a la cuarta semana de ingesta ClO2 en concentraciones de 100 mg/L se manifestó el malfuncionamiento en la tiroides de tales primates, sin embargo el mismo estudio mostró ausencia de síntomas adversos en voluntarios humanos sometidos a la ingesta de la substancia (Bercz J. P. et. al. 1982). Estudios en ratas también sometidas al consumo de ClO2 en concentraciones de 100 y 200 ppm durante ocho semanas mostraron alteraciones histológicas en las lenguas de estos roedores, estudios que también corroboraron la influencia que tiene la oxidación del ion ioduro (l-) y su metabolismo (Bercz J.P. et. al. 1986). Por otro lado, estudios en ratas llevados adelante por Harrington R. M. et al en 1986, mostraron improbable que la dosificación de dióxido de cloro ocasione una real alteración en el metabolismo de la glándula tiroidea ya que si bien esta substancia oxida los iones l- durante su paso por el tracto digestivo, el nivel de estos en sangre no se vio disminuido significativamente. También se ha visto un sutil incremento en los niveles de la hormona tiroidea (TSH) en neonatos nacidos con bajo peso en un estudio comparativo de poblaciones consumidoras y no consumidoras de agua potable tratada con dióxido de cloro en la ciudad de Quebec, Canadá (Ouhoummane N. et al. 2004). La fuerte acción oxidativa del dióxido de cloro sobre los iones ioduro puede ocasionar alteración en el metabolismo de este micronutriente que en última instancia puede derivar en consecuencias no deseadas para la glándula tiroidea.
Efectos hemolíticos han sido reportados en diferentes animales de experimentación luego de haber sido sometidos a ingestas periódicas de dióxido de cloro. Hemólisis y precipitación de la hemoglobina fueron observados en ratas, ratones y pollos luego de varios meses de dosificaciones controladas de dióxido de cloro en concentraciones de 100 mg/L, sin embargo en dicho estudio también se observó que tal daño fue fácilmente reversible (Couri D. et al. 1982). Posteriores estudios en ratas mostraron que los niveles de glutatión en sangre se vieron afectados luego de ingesta controlada de dióxido de cloro disuelto en agua pero que sin embargo fue contrarrestado por un aumento en la actividad glutatión reductasa haciendo que el nivel de glutatión vuelva a sus niveles normales luego de un tiempo de tal administración (Abdelrahman M. S. et al. 1985). También se observó que el ciclo ascorbato-glutationato fue determinante en el proceso de envejecimiento de las plantas como fue el caso con la fruta de longana, donde el tratamiento con ClO2 mostró ser benéfico para su preservación gracias a que logró retrasar el envejecimiento del fruto (Chumyam A. et al. 2017). Se evidenció que el estrés oxidativo ocasionado por el ClO2 en eritrocitos de ratas produjo precipitación de la hemoglobina como consecuencia de la acción oxidativa del glutatión sobre los grupos tiol de la hemoglobina y membrana interna de la célula (Abdelrahman M. S. et al. 1984). Por otro lado también se ha demostrado que la metahemoglobinemia inducida por el dióxido de cloro es debida al mismo ClO2 y ClO2- pero no al ClO3- (Couri D. et al. 1982; Ueno H. et al. 2000). El dióxido de cloro también es altamente reactivo con Mn+2 y Fe+2, y es por esta afinidad con este último que por oxidación a Fe+3se produce metahemoglobina con una concomitante liberación de oxígeno molecular, proveniente de la oxihemoglobina, en sangre; lo que podría explicar hipotéticamente la falsa interpretación en la oximetría de pulso de que el dióxido de sangre ocasiona una subida de la oxigenación en sangre.
ESTRUCTURA MOLECULAR Y CONFIGURACIÓN ELECTRÓNICA
El dióxido de cloro es poseedor de una estructura molecular y configuración electrónica que lo condiciona a ser un radical libre neutro. Ha sido motivo de profunda investigación desde hace varias décadas. El número impar de electrones que el átomo de cloro tiene en su orbital de enlace (nivel 3) no se explica satisfactoriamente mediante la simple estructura: O=Cl=O; en esta, la posición del séptimo electrón en el átomo de cloro no queda clara, electrón que por cierto no está apareado. Se describió un enlace de tres electrones para explicar la estructura y distribución electrónica, además de considerar imposible la estructura de la forma Cl-O-O debido a consideraciones químicas (Brockway L. O. 1933) aunque muchos años después se la ha descrito como producto, muy lábil, de una fotoisomerización estudiada en la estratosfera del polo Antártico (Vaida V. et al. 1989). Posteriores estudios sobre la geometría del ClO2 establecieron que la distancia del enlace entre el átomo de Cl y el de O es menor en comparación a similar enlace en el monóxido de cloro (ClO). Estos resultados explican y justifican muy bien la representación mediante doble enlace entre estos dos átomos, además de mostrar que las estructuras de resonancia explican satisfactoriamente el electrón no apareado del átomo de cloro, incluyendo el hecho de que los electrones llegan a regiones de orbitales d (DunitzJ.D. and Hedberg K. 1950) concluyendo que la mejor manera de representar el ClO2 es mediante dobles enlaces con resonancia. Con el paso del tiempo muchas publicaciones científicas buscaron probar la estructura y geometría molecular del ClO2, incluyendo estudios como el de su espectro infrarrojo (Hedberg K. 1951; Nielsen A. H. and Wolz P, J. H. 1952) que venían confirmando la estructura. Una muy buena revisión sobre los trabajos y técnicas utilizados en aquel entonces se encuentra en Roth W. L. 1951. Nuevos modelos como el modelo electrostático descrito por Searcy A. W. 1958 aportaron a corroborar la geometría molecular en moléculas con pares de los electrones libres no apareados tal como es el caso del ClO2 y pudiendo predecir la forma de los orbitales donde se encuentran, así también la búsqueda de generalizaciones mediante mecánica cuántica molecular empezó a explicar con más solidez el orbital de electrones no apareados (Thomas L. Allent and Harrison Shull. 1961). Paralelamente, trabajos con espectros de microondas (Curl R. F. et al. 1961) fueron afirmando la idea de que la molécula es estable y posee un electrón no apareado, además de la longitud del enlace C-O y el ángulo intramolecular O-Cl-O; otra buena revisión sobre el desarrollo de la teoría de los orbitales en los enlaces en aquel entonces puede ser leída en Mitchel K.A.R. 1969. En 1970, Clark A. H. and Beagly B. confirmaron la geometría de la estructura molecular mediante difracción de electrones sobre el ClO2, así también estudios mediante espectroscopia de vibración infrarroja y raman se mostró que el ClO2 en fase sólida no se alinea en dímeros, por lo tanto en ningún otro estado podrán encontrarse dímeros de esta substancia (Pascal J. L. et al. 1972). Con todos los trabajos mencionados y los muchos otros que existen en la literatura científica hasta el día de hoy, la estructura de resonancia de enlace de tres electrones y dos electrones es aceptada con gran consenso. Una revisión muy concisa sobre los enlaces de dos centros y tres electrones (2c-3e), de resonancia, se encuentra en Fourr'e I. and Silvi. B. 2007. La estructura aceptada (fig. 1) es aquella en la que el electrón no apareado del átomo de cloro interactúa a manera de resonancia con los átomos de oxígeno, dándole así gran reactividad a la molécula.

Figura 1. Estructura molecular de resonancia del dióxido de cloro
Estudios sobre la estructura electrónica y geometría del ClO2 siguen llevándose adelante y con mucha mayor tecnología para entender sus interacciones intermoleculares. La longitud C-O y ángulo O-C-O son de 1.49 Å y 116.5 °, respectivamente. Diferentes estudios en estado sólido y líquido se llevan adelante para entender más el comportamiento del ClO2 en cuanto a su formación de dímeros, la influencia que tiene la interacción entre los dos átomos de oxígeno y otras interacciones intra e intermoleculares (Shimaku-raH.etal. 2013).
FORMACION DE OXIGENO MOLECULAR
La formación de oxígeno molecular a partir del dióxido de cloro requiere de condiciones especiales y muy alejadas de las condiciones fisiológicas. Se ha conocido durante mucho tiempo que durante la producción de ClO2 la reacción secundaria de esta molécula con peróxido de hidrógeno (H2O2) en medio alcalino es espontánea y produce oxigeno molecular (O2) (Gordon et al. 1972, referido en Ni Y. H. and Wang X. 1997). La estructura de resonancia propuesta y probada durante varias décadas permitió dilucidar diferentes mecanismos de reacción que explican la reactividad del ClO2 en diferentes condiciones, su reactividad en medio alcalino frente al peróxido de hidrogeno se muestra en la Figura 2. Se han descrito tres mecanismos de reacción en soluciones alcalinas mediadas por iones hidroxilo (OH-) (fig. 3) de los que se puede observar que solo uno de los mecanismos muestra la formación de oxígeno molecular (Odeh I. N. et al. 2002). Así también se determinó que a concentraciones de ClO2 en el orden de los milimoles (mM) o más la relación de los iones clorito (ClO2-) y clorato (ClO3-) formados se mantiene equimolar, mientras que a concentraciones bajas, en el orden de los micro-moles (mM), la relación ClO2-: ClO3- se incrementa. Por otro lado también se estudió la reactividad del ClO2con peróxido de hidrogeno en medio ácido (pH 3-6) (Ni Y. H. and Wang X. 1997) dando como resultado iones clorato y oxigeno molecular. Otros experimentos llevados adelante con fines industriales también demostraron la generación de oxígeno molecular en condiciones de temperaturas y concentración de ácido sulfúrico (H2SO4) altas, 80 °C y 2 M, respectivamente (Burke M. et al. 1995) donde las concentraciones para el ClO2yel H2O2fueronde0.1 a 0.9 M (6746 a 60714 ppm) 0.03 a 0.12 M(1020 a 4080 ppm), respectivamente; concentraciones extremadamente altas como para considerarlas en un escenario fisiológico.
Figura 2. Mecanismo de reacción entre el dióxido de cloro y el peróxido de hidrogeno
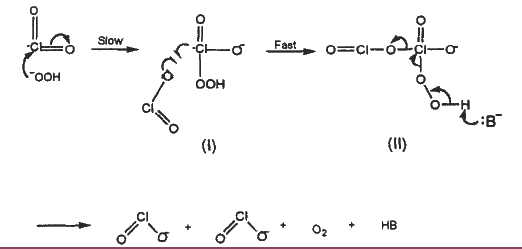
Tomado de: Mechanism and Kinetics of Chlorine Dioxide Reaction with Hydrogen Peroxide Under Acidic Conditions. Yonghao Ni and Xiaolan Wang. 1996).
Otros productos de la reactividad del ClO2 en el tratamiento de aguas son: iones clorito (ClO2-) y clorato (ClO3-). La concentración de estas moléculas debe ser detalladamente vigilada ya que por su alta reactividad pueden producir anemia hemolítica y otros daños a la salud humana (Sharma V. K. ySohnM. 2012).
Figure 3. Rutas de la descomposición del dióxido de cloro en medio alcalino.

Tomado de: Reactivity of chlorine dioxide with amino acids, peptides, and proteins. Environ Chem Lett (2012) 10:255-264. (Sharma V. K. y Sohn M. 2012)
Los estudios de reactividad del dióxido de cloro son en general llevados adelante en condiciones industriales que rara vez conllevan valores de pH neutros. En todo caso se ha visto que la reactividad del ClO2a pH neutro es lenta y no produce oxígeno molecular (von Heijner G. and Teder A. 1973).
REACTIVIDAD CON PROTEÍNAS, PÉPTIDOS Y AMINOÁCIDOS
El mecanismo por el que el dióxido de cloro tiene una gran acción antimicrobiana viene siendo descrito en varias publicaciones, se destaca su capacidad de oxidar proteínas actuando sobre ciertos aminoácidos. Los primeros estudios sobre el mecanismo de acción sobre virus mostraron su reactividad con seis aminoácidos: prolina, histidina, metionina, triptófano, tirosina y cisteína. La mayor reactividad se dio sobre: cisteína>triptófano>tirosina, pese a tal hallazgo, la inactivación del bacteriófago t2, en E. coli cepa recombinante K13, se dio por la degradación de la tirosina, cuya abundancia es mayor en la envoltura del virión (Noss C. I. et al. 1986). El mecanismo molecular de la reacción entre el dióxido de cloro con aminoácidos en condiciones de pH cercanos a las condiciones fisiológicas es presentado y explicado con detalle en Sharma, V. K. & M. Sohn. 2012; la figura 4 muestra el mecanismo de reacción del ClO2con la cisteína (-SH) y los subsecuentes productos en condiciones ácidas y en condiciones básicas.
Figura 4. Mecanismo propuesto para la reacción inicial entre ClO2 y la cisteína, con el subsecuente decaimiento de cistenil-ClO2.

Tomado de: Sharma, V. K. & M. Sohn (2012) Reactivity of chlorine dioxide with amino acids, peptides, and proteins. Environmental Chemistry Letters, 10, 255-264.
El mecanismo de reacción y los productos formados por la acción del ClO2 sobre albumina de suero bobino y glucosa-6-fosfato deshidrogenasa fueron detalladamente expuestos por Ogata N. 2007, en dicho trabajo demostró que la acción se dio sobre residuos de triptófano y tirosina formando N-formylkynurenine y 3,4-dihidroxphenilalanine (DOPA) o 2,4,5-trihidroxi-phenilalanine (TOPA) debido a modificaciones covalentes oxidativas. El rota-virus humano (HRV) ha sido estudiado concluyendo que el efecto desinfectante del ClO2 fue superior al de otras especies cloradas, se identificó daño al genoma viral aunque no se pudo relacionar tal daño con la perdida de infectividad por lo que no se podría garantizar que este tratamiento elimine la transmisión de este virus a través del agua (Xue B. et al. 2013). La reactividad que el tripéptido glutatión ha mostrado tener con el ClO2 inactivando su acción oxidante (Ison et al. 2006) es un dato que resalta de manera muy importante ya que este tripéptido es sintetizado en diferentes microorganismos así como también en el ser humano como principal substancia antioxidante parte de la respuesta liderada por especies reactivas de oxigeno (ROS).
Toda la evidencia descrita líneas arriba clarifica la razón por la que el dióxido de cloro tiene una fuerte acción antimicrobiana. Además de los aminoácidos mencionados como los más reactivos también hay los que tienen una cinética menor pero que de igual forma forman parte de lo que en última instancia pasa: precipitación de proteínas. Su uso en la industria de alimentos y en la agricultura viene incrementándose debido a esta capacidad para controlar la contaminación microbiana. Su uso en combinación con ultrasonido en la preservación post cosecha de frutos mostro de manera satisfactoria un mayor tiempo de vida, ideal para su transporte y comercialización, además de no haber quedado residuos químicos luego del tratamiento, haciendo del fruto un producto ideal para el consumo humano (Chen Z. and Zhub C. 2011). Un ejemplo de su aplicación en fase gaseosa contra el virus Tulane (virus humano) dispersado en blueberries demostró ser grandemente efectivo y probablemente muy apropiado para otros frutos similares (Kingsley D. H. et al. 2018).
Los virus son en esencia material genético encapsulado por una envoltura proteica denominada cápside. Hay virus un poco más complejos que poseen, además de la cápside, una membrana exterior (envoltura) proveniente de su célula huésped además de proteínas virales que son las responsables de interactuar con los receptores de la célula huésped para de esta forma infectarlo, tal como es el caso del SARS-CoV-2. Por todo lo expuesto previamente, se puede afirmar que el dióxido de cloro oxida las proteínas de la cápside y/o membrana viral, produciendo la inactivación del virus.
ESTUDIOS DE LA APLICACIÓN EN MODELOS ANIMALES
El uso de dióxido de cloro en fase gaseosa para contrarrestar una infección por influenza en ratones de laboratorio fue realizada por Ogata y Shibata (2008) donde la concentración utilizada fue de 0.03 ppm, valor que está muy por debajo del máximo permitido de 0.1 ppm para exposición humana en ambientes. Una proteína vital para la infectividad del virus de la influenza es la hemaglutunina (HA) misma que se encuentra en varias cepas de este virus y es responsable de la especificidad con los receptores de las células huésped, los residuos de tirosina y triptófano de esta proteína y de otras fueron degradados, ocasionando la baja en la infectividad. En 2012, Norio Ogata encontró que el residuo de triptofano 153 de la hemaglutinina fue convertido a N-formilquirurenina como consecuencia de la oxidación por ClO2. Estos resultados demostraron la capacidad del ClO2 para neutralizar virus de la influenza que poseen envoltura, como es el caso de SARS-CoV-2.
En otro estudio, ratas de laboratorio fueron tratadas con ClO2 durante seis meses y se evidenció que no hubo daño a nivel tisular en los pulmones, el peso de los animales se mantuvo dentro de lo normal en función a su ingesta normal de alimento y agua; además, análisis bioquímicos y hematológicos tampoco mostraron evidencia de alteraciones por el uso del ClO2 (Akamatsu A. et al. 2012). La producción de ClO2 mediante electrólisis de clorito de sodio mostró tener una excelente acción antimicrobiana contra virus, bacterias y hongos, pero además estudios de citotoxicidad con fibroblastos de pulmón de ratones y toxicidad por inhalación en estos animales, pruebas de irritabilidad ocular en conejos blancos, y otros parámetros mostraron baja toxicidad de la substancia producida por electrolisis (Ma J. W. et al. 2017). El virus del síndrome reproductivo y respiratorio porcino (PRRSV), más conocido como virus de la gripe porcina, fue sometido a estudios con las líneas celulares Marc-145 y macrófagos alveolares porcinos tomados de animales no infectados (Zhu Z. et al. 2019); ambas líneas celulares fueron tratadas con ClO2 con el objetivo de estudiar su acción sobre la infectividad del PRRSV demostrando que hubo daño a nivel proteico y genético sobre el virus, lo que explicó la inhibición de la infección en tales cultivos celulares; un dato por demás importante para considerar es que dicho estudio mostró que el ClO2 produjo, también, un decrecimiento en la producción de citoquinas inflamatorias inducidas por PRRSV.
Un estudio clínico en el que se administró ClO2, ClO2- y ClO3 - a humanos mostró ausencia de daño fisiológico (LubbersJ. R. et al. 1982). En dicho estudio se administraron las especies cloradas por vía oral en tres fases durante doce semanas; los sujetos de estudio fueron personas normales, personas con deficiencia de glucosa 6 fosfato deshidrogenasa y personas con riesgo de deficiencia de la enzima mencionada; para todos ellos la administración fue de 5 mg/L. El estudio concluye afirmando que se demostró la no toxicidad de esta administración. Sin embargo es muy importante tener en cuenta que en tal estudio no se trató infección microbiana alguna, por lo que no se puede concluir que el dióxido de cloro fue administrado con éxito para curar una enfermedad infecciosa inactivando un virus u otro tipo de microorganismo.
Para entender la baja toxicidad del dióxido de cloro en organismos superiores como el ser humano Noszticzius Z. et al en 2013 realizaron estudios de permeabilidad con gelatina y vejiga de cerdo usadas como membranas para verificar la difusión de la molécula a través de entornos más complejos como de los mamíferos, así también relacionaron tales resultados con su acción contra microorganismos y su efecto citotóxico. Una característica muy importante y particular del ClO2 es su tamaño y mayor especificidad reactiva con las biomoléculas descritas con anterioridad. En comparación con el ácido hipocloroso (HClO) y el ácido hipoiodoso (HIO) el dióxido de cloro tiene una velocidad de reacción mucho mayor y hasta puede reaccionar en estado gaseoso. La oxidación del tripéptido glutatión por ClO2 y HClO tiene diferentes productos con diferentes implicaciones para un organismo superior, por un lado la formación de disulfito de glutatión (GS-SG) por la oxidación debida al ClO2 es reversible debido a que dicho producto es fácilmente reducido por la glutatión reductasa para producir nuevamente glutatión (GSH) y así los niveles en sangre no bajan teniendo al tripéptido listo para más acción antioxidante; por el otro lado el producto de la oxidación del glutatión por HClO es glutatión sulfonamida (GSA) substancia que no puede ser revertida a glutatión como en el anterior caso. Tejidos delgados como la pleura pueden ser más susceptibles a la acción del dióxido de cloro, sin embargo la alta irrigación sanguínea en tal tejido podría mitigar el efecto citotóxico. La reactividad de especies como el HOCl, HOI y el ClO2 con grupos tioles, que son grupos de alta importancia en infinidad de procesos biológicos, explica por qué los microorganismos no desarrollan resistencia contra estas especies altamente reactivas y en especial contra el ClO2 debido a su gran velocidad de reacción. El tamaño y selectividad del ClO2 hacen de esta molécula grandemente eficiente contra microorganismos y posiblemente poco tóxica para organismos superiores.
La generación de radicales libres y otras especies de gran reactividad por parte del sistema inmune humano incluye especies altamente reactivas como el anión súperoxido (O2-), hidroxilo (OH-), singuletes de oxigeno (+O2), peróxido de hidrogeno (H2O2) y otras son parte de la respuesta liderada por especies reactivas de oxigeno (ROS). Esta generación de especies altamente reactivas incluye la generación de ácido hipocloroso (HClO) a partir de H2O2 que mediante una cadena de reacciones deriva en la producción de Cl2, gas que fue usado en altas concentraciones durante la primera guerra mundial como la primera arma química. Debido a la alta reactividad de estas moléculas, los microorganismos que proliferen son blancos de degradación a diferentes niveles moleculares que van desde las membranas de la envoltura, proteínas de superficie, proteínas vitales al interior del microorganismo y material genético. Este "fuego cruzado" también puede afectar a más de una célula del huésped infectado, las enfermedades autoinmunes como la esclerosis múltiple, las personas con deficiencias de la enzima glucos 6-fosfato deshidrogenasa que son susceptibles al estrés oxidativo y otras patologías demuestran bien este hecho; es una suerte de costo beneficio que mejora en la medida en que el organismo huésped mejora su respuesta inmune y seguramente también como especie mejora en términos evolutivos. Se estudiaron comparativamente la acción del ClO2 sobre la enzima glucosa 6-fosfato deshidrogenasa, glutatión peroxidasa y glutatión obteniéndose como resultado que el menor de los efectos tóxicos fue dado en células humanas más que en células de roedores, así también la formación de peróxido de hidrogeno y hemolisis (Ueno H. et al. 2000). Por otro lado, la producción de ClO2 en bacterias está documentada y se da como defensa ante agresiones de otros microorganismos.
En abril de 2020 salió una publicación denominada: "Can chlorine dioxide prevent the spreading of coronavirus or other viral infections? Medical hypotheses" (¿Puede el dióxido de cloro prevenir la dispersión del coronavirus u otras infecciones virales? Hipótesis médica) escrita por tres investigadores de dos universidades de Budapest, Hungría (Kaly-Kullai K. et al. 2020) haciendo una revisión sobre las posibilidades de uso del dióxido de cloro. Concluye sugiriendo el uso de esta substancia bajo los parámetros de seguridad mostrados en diferentes estudios ante la pandemia del Covid-19 hasta que se desarrollen moléculas más específicas. Tal escenario podría pensarse viable en una situación de extrema emergencia, pero terminaría siendo muy arriesgado y prácticamente a ciegas ya que no existe estudio clínico en humanos que haya demostrado su eficacia contra virus alguno. Solo se pueden tener hipótesis sobre cuál sería su accionar en el organismo ante la infección pero no pruebas, seguramente podrá inactivar al virus en alguna medida, pero esta inactivación no ha sido estudiada en condiciones controladas para poder evitar daño a órganos internos. En gran medida la existencia de tratamientos alternativos ha demostrado ser eficaz contra el SARS-CoV-2, si bien no existe fármaco que haya demostrado su eficacia total contra este virus, tales fármacos son aprobados para su uso en humanos y son seguros de usar bajo las prescripciones médicas correspondientes. Es cierto que no deja de llamar la atención el posible potencial que puede tener el dióxido de cloro para uso clínico pero mientras no se tengan estudios clínicos certeros y puntuales frente a infecciones concretas, no puede darse vía libre a su uso.
CONCLUSIONES
La evidencia sólida de la estructura y geometría molecular, configuración electrónica y reactividad del dióxido de cloro permite desmitificar más de un argumento que se ha ido presentando en pro del uso de esta substancia. En primer lugar, no existe evidencia alguna que demuestre un desprendimiento simple y sencillo de una molécula de oxígeno para ser asimilada por las células de un tejido afectado por la infección como se viene sosteniendo falsamente. Como se ha demostrado, tal generación de oxígeno se da en condiciones muy diferentes a las fisiológicas, por lo tanto, la posibilidad de que esta "liberación de oxígeno" sea la razón por la que los pacientes de Covid-19 recuperen carece totalmente de sustento científico. De igual importancia es refutar la afirmación que esta sería una vía aceptable de oxigenación de las células, el intercambio gaseoso mediado por la hemoglobina que los eritrocitos llevan y que transporta oxigeno molecular para distribuirlo por todo el organismo es el mecanismo de oxigenación celular aceptado y probado universalmente, la pretensión de súbitamente imponer un nuevo mecanismo de asimilación de oxígeno es inaceptable. La afirmación de un incremento oxigenación de la sangre por las lecturas en oxímetros de pulso Lavero, es completamente inconsistente debido a la imposibilidad de que el dióxido de cloro libere oxígeno molecular, tales lecturas se pueden explicar por la liberación de la hemoglobina como producto de la hemolisis producida, dando una falsa lectura de oxigenación en sangre. Es así como la promoción de la substancia antiséptica tiene a mucho desmedro suyo una lista de inconsistencias científicas mayúsculas que son inaceptables.
Todos los datos que muestran su eficacia y seguridad en experimentos en animales de laboratorio no dan pie a extrapolar tales datos para su uso en seres humanos. Hace falta muchos datos que puedan mostrar su efecto en seres humanos ante diferentes infecciones, solo existe el estudio clínico de Lubbers que muestra seguridad en su administración, pero es muy importante tener en cuenta que tal estudio no incluyó infección alguna en los sujetos de estudio. Hasta el momento su uso en ambientes está reglamentado y es seguro a las concentraciones correctas. Para garantizar que la concentración de dióxido de cloro sea constante durante los tiempos de aplicación se deberá contar con equipamiento que garantice una aplicación homogénea.
Ante tanta evidencia en modelos animales que muestran una baja toxicidad del dióxido de cloro administrado en bajas concentraciones y su muy probable baja difusión en tejidos animales queda hacer estudios clínicos más objetivos y ante agentes patógenos modelos para poder dilucidar si alguna vez podrá llegar a ser posible su uso ante ciertas infecciones. Si esta molécula llega a ser bien estudiada en escenarios clínicos reales podrá decirse a ciencia cierta ante qué puede ser seguro su uso, antes no.
REFERENCIAS BIBLIOGRÁFICAS
Abdelrahman, M. S., Couri, D., and Bull, R. J. (1984) EFFECT OF EXOGENOUS GLUTATHIONE, GLUTATHIONE-REDUCTASE, CHLORINE DIOXIDE, AND CHLORITE ON OSMOTIC FRAGILITY OF RAT-BLOOD INVITRO, Journal of the American College of Toxicology 3,269-275.
Abdelrahman, M. S., Couri, D., and Bull, R. J. (1985) TOXICITY OF CHLORINE DIOXIDE IN DRINKING-WATER, Journal of Environmental Pathology Toxicology and Oncology 6, 105-113.
Akamatsu, A., Lee, C., Morino, H., Miura, T., Ogata, N., and Shibata, T. (2012) Six-month low level chlorine dioxide gas inhalation toxicity study with two-week recovery period in rats, Journal of Occupational Medicine and Toxicology 7.
Bercz, J. P., Jones, L. L., Harrington, R. M.,Bawa, R., and Condie, L. (1986) MECHANISTIC ASPECTS OF INGESTED CHLORINE DIOXIDE ON THYROID-FUNCTION - IMPACT OF OXIDANTS ON LODIDE METABOLISM, Environmental Health Perspectives 69, 249-255.
Bercz, J. P., Jones, L., Garner, L., Murray, D., Ludwig, D. A., and Boston, J. (1982) SUB-CHRONIC TOXICITY OF CHLORINE DIOXIDE AND RELATED-COMPOUNDS IN DRINKING-WATER IN THE NON-HUMAN PRIMATE,Environmental Health Perspectives 46, 47-55.
Brockway, L. O. (1933) The three-electron bond in chlorine dioxide, Proceedings of the National Academy of Sciences of the United States of America 19, 303-307.
Burke, M., Hoq, M. F., and Ernst, W. R. (1995) Rate of reaction of chlorine dioxide and hydrogen peroxide, Chemical Engineering Journal and the Biochemi-cal Engineering Journal 60, 101-104.
Carrillo, A., Puente, M. E., and Bashan, Y. (1996) Application of diluted chlorine dioxide to radish and lettuce nurseries insignificantly reduced plant development, Ecotoxicology and Environmental Safety 35, 57-66.
Chen, Z., and Zhu, C. H. (2011) Combined effects of aqueous chlorine dioxide and ultrasonic treatments on postharvest storage quality of plum fruit (Prunus salicina L.), Postharvest Biology and Technology 61, 117-123.
Chumyam, A., Shank, L., Faiyue, B., Uthaibutra, J., and Saengnil, K. (2017) Effects of chlorine dioxide fumigation on redox balancing potential of antioxidative ascorbate-glutathione cycle in 'Daw' longan fruit during storage, Scientia Horticulturae 222, 76-83.
Clark, A. H., and Beagley, B. (1970) AN ELECTRON DIFFRACTION INVESTIGATION OF GASEOUS CHLORINE DIOXIDE, Journal of the Chemical Society a -Inorganic Physical Theoretical, 46-&.
Couri, D., Abdelrahman, M. S., and Bull, R. J. (1982) TOXICOLOGICAL EFFECTS OF CHLORINE.
Curl, R. F., Sugden, T. M., Baird, J. C., Kenney, C. N., Kinsey, J. L., Jenkins, D. R., Bird, G. R., Baker, J. G., and Heidelberg, R. F. (1961) MICROWAVE SPECTRUM OF CHLORINE DIOXIDE .1. ROTATION-AL ASSIGNMENT, Physical Review 121, 1119-&.
Dunitz, J. D., and Hedberg, K. (1950) A RE-INVESTIGATION OF THE STRUCTURES OF CHLORINE MONOXIDE AND CHLORINE DIOXIDE BY ELECTRON DIFFRACTION, Journal of the American Chemical Society 72, 3108-3112.
Fourre, I., and Silvi, B. (2007) What can we learn from two-center three-electron bonding with the topological analysis of ELF?, Heteroatom Chemistry 18, 135-160.
Harrington, R. M., Shertzer, H. G., and Bercz, J. P. (1985) EFFECTS OF CLO2 ON THE ABSORPTION AND DISTRIBUTION OF DIETARY IODIDE IN THE RAT, Fundamental and Applied Toxicology 5, 672-678.
Harrington, R. M., Shertzer, H. G., and Bercz, J. P. (1986) EFFECTS OF CHLORINE DIOXIDE ON THYROID-FUNCTION IN THE AFRICAN-GREEN MONKEY AND THE RAT, Journal of Toxicology and Environmental Health 19, 235-242.
Hedberg, K. (1951) THE INFRARED SPECTRA OF CL2O AND CLO2, Journal of Chemical Physics 19, 509-509.
Ison, A., Odeh, I. N., and Margerum, D. W. (2006) Kinetics and mechanisms of chlorine dioxide and chlorite oxidations of cysteine and glutathione, Inorganic Chemistry 45, 8768-8775.
Kaly-Kullai, K., Wittmann, M., Noszticzius, Z., and Rosivall, L. (2020) Can chlorine dioxide prevent the spreading of coronavirus or other viral infections? Medical hypotheses, Physiology International 107,1-11.
Kingsley, D. H., Perez-Perez, R. E., Niemira, B. A., and Fan, X. T. (2018) Evaluation of gaseous chlorine dioxide for the inactivation of Tulane virus on blueberries, International Journal of Food Microbiology 273, 28-32.
Korich, D. G., Mead, J. R., Madore, M. S., Sinclair, N. A., and Sterling, C. R. (1990) EFFECTS OF OZONE, CHLORINE DIOXIDE, CHLORINE, AND MONOCHLORAMINE ON CRYPTOSPORIDIUMPAR-VUM OOCYST VIABILITY, Applied and Environmental Microbiology 56, 1423-1428.
Lubbers, J. R., Chauan, S., and Bianchine, J. R. (1982) CONTROLLED CLINICAL-EVALUATIONS OF CHLORINE DI-OXIDE, CHLORITE AND CHLORATE IN MAN, Environmental Health Perspectives 46, 57-62.
Ma, J. W., Huang, B. S., Hsu, C. W., Peng, C. W., Cheng, M. L., Kao, J. Y., Way, T. D., Yin, H. C., and Wang, S. S. (2017) Efficacy and Safety Evaluation of a Chlorine Dioxide Solution, International Journal of Environmental Research and Public Health 14.
Mitchell, K. A. (1969) USE OF OUTER DOR-BITALS IN BONDING, Chemical Reviews 69,157-&.
Ni, Y. H., and Wang, X. L. (1997) Mechanism and kinetics of chlorine dioxide reaction with hydrogen peroxide under acidic conditions, Canadian Journal of Chemical Engineering 75, 31-36.
Nielsen, A. H., and Woltz, P. J. H. (1952) THE INFRARED SPECTRUM OF CHLORINE DIOXIDE, Journal of Chemical Physics 20,1878-1883.
Noss, C. I., Hauchman, F. S., and Olivieri, V. P. (1986) CHLORINE DIOXIDE REACTIVITY WITH PROTEINS, Water Research 20, 351-356.
Noszticzius, Z., Wittmann, M., Kaly-Kullai, K., Beregvari, Z., Kiss, I., Rosivall, L., and Szegedi, J. (2013) Chlorine Dioxide Is a Size-Selective Antimicrobial Agent, Plos One 8.
Odeh, I. N., Francisco, J. S., and Margerum, D. W. (2002) New pathways for chlorine dioxide decomposition in basic solution, Inorganic Chemistry 41, 6500-6506.
Ogata, N. (2007) Denaturation of protein by chlorine dioxide: Oxidative modification of tryptophan and tyrosine residues, Biochemistry 46, 4898-4911.
Ogata, N. (2012) Inactivation of influenza virus haemagglutinin by chlorine dioxide: oxidation of the conserved tryptophan 153 residue in the receptor-binding site, Journal of General Virology 93, 2558-2563.
Ogata, N., Sakasegawa, M., Miura, T., Shibata, T., Takigawa, Y., Taura, K., Taguchi, K., Matsubara, K., Nakahara, K., Kato, D., Sogawa, K., and Oka, H. (2016) Inactivation of Airborne Bacteria and Viruses Using Extremely Low Concentrations of Chlorine Dioxide Gas, Pharmacology 97, 301-306.
Ogata, N., and Shibata, T. (2008) Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection, Journal of General Virology 89, 60-67.
Ouhoummane, N., Levallois, P., and Gingras, S. (2004) Thyroid function of new-borns and exposure to chlorine dioxide by-products, Archives of Environmental Health 59, 582-587.
Pascal, J. L., Pavia, A. C., and Potier, J. (1972) CRYSTAL-STRUCTURE OF CLO2 BY RAMAN AND INFRARED VIBRATION SPECTROSCOPY, Journal of Molecular Structure13, 381-&.
Peeters, J. E., Mazas, E. A., Masschelein, W. J., Dematurana, I. V. M., and Debacker, E. (1989) EFFECT OF DISINFECTION OF DRINKING-WATER WITH OZONE OR CHLORINE DIOXIDE ON SURVIV-AL OF CRYPTOSPORIDIUM-PARVUM
OOCYSTS, Applied and Environmental Microbiology 55,1519-1522.
Roth, W. L. (1951) EXPERIMENTAL MOLECULAR STRUCTURE, Annual Review of Physical Chemistry 2, 217-234.
Sanekata, T., Fukuda, T., Miura, T., Morino, H., Lee, C., Maeda, K., Araki, K., Otake, T., Kawahata, T., and Shibata, T. (2010) Evaluation of the Antiviral Activity of Chlorine Dioxide and Sodium Hypochlorite against Feline Calicivirus, Human Influenza Virus, Measles Virus, Canine Distemper Virus, Human Herpesvirus, Human Adenovirus, Canine Adenovirus and Canine Parvovirus, Biocontrol Science 15, 45-49.
Searcy, A.W. (1958) ELECTROSTATIC MODEL FOR PREDICTION OF SHAPES OF COVALENT MOLECULES AND IONS, Journal of Chemical Physics 28, 1237-1242.
Sharma, V. K., and Sohn, M. (2012) Reactivity of chlorine dioxide with amino acids, peptides, and proteins, Environmental Chemistry Letters 10, 255-264.
Shimakura, H., Ogata, N., Kawakita, Y., Ohara, K., and Takeda, S. (2013) Determination of the structure of liquids containing free radical molecules: Intermolecular correlations in liquid chlorine dioxide, Molecular Physics 111, 1015-1022.
Thomas L. A. and Harrison S. (1961) The Chemical Bond in Molecular Quantum Mechanics, The Journal of Chemical Physics. Vol. 35, number 5
Thurston-Enriquez, J. A., Haas, C. N., Jaca-ngelo, J., and Gerba, C. P. (2005) Inactivation of enteric adenovirus and feline calicivirus by chlorine dioxide, Applied and Environmental Microbiology 71, 3100-3105.
Ueno, H., Sayato, Y., and Nakamuro, K. (2000) Hematological effects of chlorine dioxide on in vitro exposure in mouse, ratand human blood and on subchronic exposure in mice, Journal of Health Science 46,110-116.
Vaida, V., Solomon, S., Richard, E. C., Ruhl, E., and Jefferson, A. (1989) PHOTOISOMERIZATION OF OCLO - A POSSIBLE MECHANISM FOR POLAR OZONE DEPLETION, Nature 342, 405-408.
Heijner G. and Teder A. (1973) Kinetics of the Decomposition of Aqueous Chlorine Solutions, Acta Chem Scand. 27 No 10.
Wilson, S. C., Brasel, T. L., Martin, J. M., Wu, C., Andriychuk, L., Douglas, D. R., Cobos, L., and Straus, D. C. (2005) Efficacy of chlorine dioxide as a gas and in solution in the inactivation of two trichothecene mycotoxins, International Journal ofToxicology24, 181-186.
Xue, B., Jin, M., Yang, D., Guo, X., Chen, Z. L., Shen, Z. Q., Wang, X. W., Qiu, Z. G., Wang, J. F., Zhang, B., and Li, J. W. (2013) Effects of chlorine and chlorine dioxide on human rotavirus infectivity and genome stability, Water Research 47, 3329-3338.
Zhang, A., Li, Y., Song, Y., Lv, J., and Yang, J. (2014) Characterization of pharmaceuticals and personal care products as N-nitrosodimethylamine precursors during disinfection processes using free chlorine and chlorine dioxide, Journal of Hazardous Materials 276, 499-509.
Zhu, Z. B., Guo, Y., Yu, P., Wang, X. Y., Zhang, X. X., Dong, W. J., Liu, X. H., and Guo, C. H. (2019) Chlorine dioxide inhibits the replication of porcine reproductive and respiratory syndrome virus by blocking viral attachment, Infection Genetics and Evolution 67, 78-87.












 uBio
uBio 

