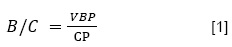INTRODUCCIÓN
Durante la década de los 80`s el Profesor Teruo Higa de la Universidad de Ryukyus, Okinawa, estudio el uso de microorganismos eficientes en el mejoramiento del crecimiento de las plantas y su acción contra las plagas y enfermedades en ellas (EEAITAJ, 2013). El Dr. Cho Han de Corea del Sur desarrollo una agricultura natural en la década de los 70's, asiéndola simples, practica, innovadora y replicable para el beneficio de los pequeños agricultores, en base al uso de microorganismos indígenas (IMO), minerales y materia orgánica (Reddy, 2011).
El uso de microorganismos en la agricultura no es un concepto nuevo, es una práctica antigua que se vio afectada con la llegada de la “Revolución Verde”. El estudio de los microorganismos nativos en otros países, en los que el suelo está muriendo (EEAITAJ, 2013), promete una alternativa amigable y económica para la agricultura, mejorando de esta manera la calidad de los alimentos que consumimos (Restrepo, 2007).
Entre las acciones a realizarse para reproducir los microorganismos nativos, está el hecho de obtener la hoja rasca (hojas caídas y en descomposición) de los bosques. Sin embargo, en una zona de clima seco como lo es el Altiplano Boliviano, y que además carece de áreas boscosas, pensar en esta posibilidad conlleva un gasto en el trasporte del material requerido.
Por tal motivo la Estación Experimental Choquenaira desea trabajar con esta línea de investigación, considerando que se tienen pocos estudios sobre esta temática en esta zona y además de esta manera se podrá promover las técnicas de agroecología, enfocados en el mediano y pequeño productor.
En este sentido la presente investigación tiene como objetivo producir un biofertilizante mineralizado en la Estación Experimental Choquenaira para incentivar técnicas agroecológicas; además de evaluar la eficiencia del biofertilizante mineralizado en un cultivo controlado (Biotest), Analizar la composición fisicoquímica, química y microbiológica del Biofertilizante mineralizado más eficiente y analizar la relación costo-beneficio del biofertilizante mineralizado obtenido para incentivar técnicas agroecológicas.
MATERIALES Y MÉTODOS
Ubicación de la zona de estudio
El área de estudio donde se obtuvieron los microorganismos nativos del Altiplano (MONA), está localizada en el Estación Experimental Choquenaira dependiente de la Facultad de Agronomía de la Universidad Mayor de San Andrés, municipio de Viacha, Bolivia. Ubicada geográficamente entre las coordenadas 16° 42' 5'' de latitud sur y 68° 15' 54'' longitud oeste a una altitud de 3 820 m s.n.m. (Tambo et al., 2016).
Metodología
Etapa 1: recolección y reproducción de los mona
Se seleccionaron tres especies nativas presentes en la Estación Experimental, la Festuca orthophylla (paja), Buddleja coriacea (qhiswara) y Baccharis boliviensis (tola), de las cuales se realizó una prueba cualitativa de la salud del suelo, a nivel de la rizosfera de cada especie seleccionada, mediante pruebas de cromatografía de papel circular Pfeifer en suelos1.El procedimiento que se siguió fue el propuesto por Restrepo y Pinheiro (2011). El cual se divide en dos procesos uno en el campo, con el muestreo y la preparación previa de la muestra de suelo y otra en el laboratorio que consiste en la preparación de los reactivos, papel filtro y el análisis en sí.
Para realizar la recolección de los microorganismos nativos del Altiplano (MONA), se seleccionó la especie que presentó un suelo con abundante actividad microbiológica, esto puede ser verificado mediante los resultados de las pruebas de cromatografía en papel. Posteriormente se emplearon trampas de arroz (Figura 1), preparadas según el procedimiento propuesto por Simón (2015). Las trampas de arroz se prepararon de la siguiente manera: (a) se colocó arroz precocido en un recipiente limpio y desinfectado con peróxido de hidrógeno al 3 %, (b) se recubrió con gaza (10 x 10 cm). Las trampas se dejaron enterradas en el suelo, a una profundidad de 5 a 10 cm a nivel de la rizosfera de una especie nativa y se evaluó el tiempo de inoculación.
Pasado el tiempo óptimo de inoculación, se procedió a su preproducción mediante el método que el Dr. Cho Han Kyu propone (Reddy, 2011); el método consiste en mezclar el contenido de las trampas de arroz con azúcar morena en una relación de 1:1, pero en este caso se utilizó Chancaca. Posteriormente se dejó reposar por siete días antes de la mezcla con los demás materiales.
Etapa 2: elaboración del biol mineralizado
Para desarrollar el biol mineralizado se selección tres diferentes tipos de rocas (andesita, cuarcita y caliza). Se seleccionó estas rocas por la disponibilidad que estas tienen en la Estación Experimental. Pasado el tiempo de reproducción de los MONA se procede a realizar distintas mezclas con la roca pulverizada y biol, como base del biol mineralizado. Para esta mezcla se usa biol recién cosechado para tener un máximo de microorganismos posibles. Se estableció un tiempo de fermentación de tres meses, que es el tiempo que recomiendan Alvarez (2010) y Mamani et al. (2018) para climas fríos, en la elaboración de biol.
Se formuló tres mezclas de biol mineralizado (Tabla 1), con tres diferentes tipos de rocas para cada una y se aplicaron tres repeticiones. Las cantidades de cada uno de los ingredientes se calcularon en base a estudios anteriores sobre la elaboración de bioles y la dimensión de los tanques de fermentación.
Tabla 1 Dosis para la elaboración de los biol mineralizado.

MONA = microorganismos nativos del Altiplano.
Etapa 3: aplicación de las mezclas de biol mineralizado a los biotest
La planta seleccionada para la realización de los biotest fue: lechuga (Lactuca sativa L.) crespa por su resistencia a las bajas temperaturas.
Diseño experimental: para probar la efectividad de las mezclas de biol mineralizado en el cultivo de lechuga, se realizó un análisis de varianza ANOVA (Analysis of Variance, en inglés), con el paquete informático IBM SPSS Statistic versión 22 para observar si existen diferencias estadísticamente significativas, con respecto a la aplicación de MONA en dichas mezclas. Se empleó el diseño completamente al azar (DCA) con tres repeticiones y dos testigos con tres repeticiones.
Hipótesis estadística: a) H0. La aplicación de MONA en el biol mineralizado no influye en el desarrollo de las plantas de lechugas con un nivel de significancia del 5 %; b) H1. La aplicación de MONA en el biol mineralizado influye en el desarrollo de las plantas de lechugas con un nivel de significancia del 5 %. Si el grado de significancia de los datos arroja un valor por debajo de 5 % (P<0.05), nos indica que H1 es verdadera, denotándose que existen diferencias estadísticamente significativas entre las mezclas, afectando el crecimiento de las lechugas.
Variable independiente: biol con adición de roca pulverizada y MONA.
Variable dependiente: número de hojas (m), altura de la planta (m), diámetro del cogollo (cuello de la planta, m), diámetro de la cobertura foliar (m), peso de la producción (kg).
Número de unidades experimentales: seis unidades experimentales más dos testigos. Se realiza el tratamiento por triplicado.
Variables de respuesta: se realizó la medición de las siguientes variables: número de hojas (m), altura de la planta (m), diámetro del cogollo (m), diámetro de cobertura foliar (m), peso (kg).
Aplicación de las mezclas de biol mineralizado: la primera aplicación fue posterior al trasplante, esto para reducir el riesgo de mortalidad de los plantines, la aplicación fue al 30 % en el suelo. Si bien la aplicación posterior puede ir de un 3 a 7 % de concentración (Restrepo, 2007), la dosificación elegida fue del 6 % de manera foliar cada 15 días hasta la cosecha, tal como lo indica la investigación de Pomboza et al. (2016).
Etapa 4: análisis fisicoquímico y microbiológico
Análisis fisicoquímico: se realizó un análisis químico de la roca pulverizada y de la mezcla que tuvo la mejor respuesta, según las variables agronómicas, y los análisis físicos: pH, C.E., densidad.
Análisis microbiológico: Se realizarán los siguientes análisis: recuento de coliformes totales, bacterias mesófilas y mohos y levaduras. Además de realizarse estos análisis de rutina se realizó un recuento de microorganismos específicos, fijadores de nitrógeno, solubilizadores de fósforo, solubilizadores de potasio y solubilizadores de calcio. Para ello se tuvo que armar los agares a utilizar como se muestra en la siguiente Tabla 2:
Se realizó una siembra en superficie, se esparció 0.1 ml de muestra sobre placas preparadas, haciendo la expansión con un asa de Digalsqui previamente desinfectada.
Etapa 5: análisis costo beneficio
Para la determinación de esta variable se consideró el valor de la materia prima, herramientas, transporte de materiales y mano de obra. El propósito de este análisis fue para ver si el trabajo de investigación presenta rentabilidad. La relación beneficio/costo se calculó dividiendo el valor bruto de la producción y el costo de producción (Eciación 1).
Dónde: B/C = Beneficio costo (USD); VBP = valor bruto de la producción (USD); CP = costos de producción (USD).
RESULTADOS Y DISCUSIÓN
Resultado de la cromatografía de suelos
El análisis de cromatografía de suelos se realizó en las instalaciones de la Estación Experimental Choquenaira. La valoración de los cromas que se realizaron, tras el análisis cualitativo de cromatografía de suelos, presentaron los siguientes resultados (Tabla 3):
Viendo los resultados revelados por los cromatogramas se opta por realizar la recolección de los MONA a nivel de la rizosfera de la qhiswara, ya que sus características nos permitirán tener una mayor diversidad de microorganismos.
Recolección y reproducción de los MONA
Considerando que la temperatura del altiplano suele ser menor a los 20 °C, se prepararon varias trampas, las cuales se desenterraron a los 10, 15 y 20 días, para realizar un seguimiento visual del desarrollo de los MONA y poder establecer un tiempo óptimo de inoculación. En la Figura 2 se puede observar la diferencia que existe entre los tiempos de inoculación, a los 20 días las trampas empiezan a secarse, mostrando una coloración más oscura. Simón (2015) establece que las colonias de microorganismos de colores verde y blanco son los que requerimos para la posterior reproducción. Considerando esta referencia y las bajas temperaturas del altiplano se estableció un periodo de 10 a 15 días de espera para que los MONA se inoculen las trampas de arroz enterradas. Se realiza la mezcla del arroz inoculado y Chancaca, después de siete días de reposo, los MONA adquieren un aroma dulce parecido al del batido de bicervecina.
Elaboración de las mezclas de biol mineralizado
La elaboración del biol mineralizado tuvo un proceso de fermentación de tres meses, tiempo en el cual alcanzaron la madurez adecuada y estuvieron listos para su posterior dosificación en los biotest y el análisis en el laboratorio. Como bien indica Restrepo (2007) la formación de la nata y/o espuma blanca es un indicador de calidad del biol, si este fuera de color verde azulado o violeta indican un mal proceso de fermentación y el producto debe ser descartado. De esta manera se puede realizar un examen visual de calidad al observar en la Figura 3 la presencia de la nata blanca en las diferentes mezclas. Estando en mayor presencia en las mezclas M1xR3, M1xR2 y M1xR1, siendo estas las que contienen los MONA, indicando así que los agregados de estos mejoran la calidad del biol.
Variables de respuesta de los biotest
Para realizar el análisis de la varianza se considera dos grupos; M0 que no contienen MONA y M1 que contiene MONA, además de dos testigos. Con los datos obtenidos se realizó los siguientes análisis de varianza (al 95 % de confianza) para el número de hojas, altura de la planta, diámetro del cogollo (cuello de la planta), diámetro de la cobertura foliar, peso de la planta. Al evidenciar que la hipótesis alterna se acepta en tres de las cinco variables de respuesta se establece que la aplicación de MONA en las mezclas de biol mineralizado influye de manera positiva en el desarrollo de la planta de lechuga. Se observa que la mezcla M1 x R1 obtuvo un mejor rendimiento en el número de hojas, en la altura y en el peso de la planta. Esto indica que la mezcla M1 x R1, (biol + andesita + microorganismos nativos del Altiplano) es la que mejor resultados obtuvo por lo que se procedió a realizar el análisis químico de esta mezcla.
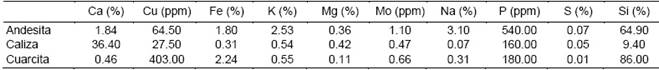
Análisis químico las rocas
Según los resultados presentados en la Tabla 4 la andesita presenta una mayor diversidad de elementos en cantidad superiores con respecto a la caliza, que es superior solo en calcio con un 36.40 %, y a la cuarcita, que es superior solo en el silicio con un 86.00 %, el hierro con 2.24 % y el cobre con 403.00 ppm.
Análisis de fisicoquímico de las mezclas de biol mineralizado elaborados
Entre los parámetros de calidad que se consideran para la elaboración del biol mineralizado, están el pH y la conductividad eléctrica, como se muestra en la Tabla 5. El pH y la conductividad eléctrica se comparan con la NMX-FF-109-SCFI-2008 (Comité de Normalización Ambiental del Distrito Federal, 2007) Norma Mexicana “Humus de lombriz”, a falta de una norma específica para biofertilizantes en el país. Se puede observar que la conductividad eléctrica está por debajo de la norma lo que facilita el intercambio iónico.
Tabla 5 Resultados de densidad pH y C.E. de las mezclas de biol mineralizado.
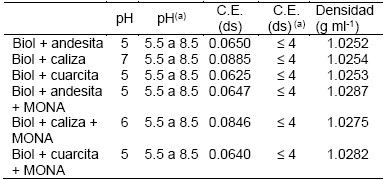
C.E. = conductividad eléctrica; a Según la norma NMX-FF-109- SCFI-2008
Si bien el pH de las mezclas M0xR1, M0xR3, M0xR1 y M1xR3 están fuera del rango establecido por la norma la NMX-FF-109-SCFI-2008, estos han actuado adecuadamente durante la aplicación a los biotest, asimismo al diluir los estas mezclas de biol mineralizado, se observó que el pH llega a establecerse entre 6 y 7. Durante el proceso de fermentación el comportamiento del pH nos muestra una tendencia hacia la acides. Estos fertilizantes pueden ser recomendados para tierras alcalinas.
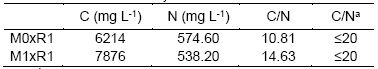
Los resultados presentados en la Tabla 6 indican que la mezcla M1xR1 tiene una mayor concentración de calcio, hierro, potasio, magnesio, sodio, y silicio, en comparación a la mezcla M0xR1. Además, se analizó la cantidad de nitrógeno y carbono (Tabla 7) que al comparar su relación con la norma NMX-FF-109-SCFI- 2008 se puede observar que esta es menor a 20, lo que indica un nivel alto de nitrógeno en las mezclas de biol mineralizado, probando una vez más su calidad.
Tabla 6 Análisis químico de las mezclas de biol mineralizado M0xR1 y M1xR1
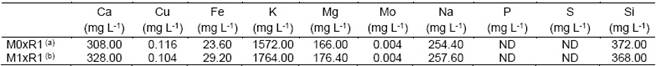
Extraído del reporte del análisis de laboratorio “spectrolab”, según requerimientos solicitados; a M0xR1; biol + andesita; b M1xR1; biol + andesita + microorganismos nativos del Altiplano; ND = no determinado.
Análisis microbiológico
En el caso de la elaboración de las mezclas de biol mineralizado se tomó como referencia dos de los preparados, uno que contiene MONA y el otro que no la contiene, se toma la mezcla con andesita ya que es la que contiene mayor cantidad de minerales.
Como se puede observar en los resultados de la Tabla 8, el NMP ml-1 de cada mezcla es menor al límite establecido según las normas mexicanas NMX-FF-109-SCFI-2008 y NADF-020-AMBT-2011 (Comité de Normalización Ambiental del Distrito Federal, 2012). Además de ello destaca que la concentración de Escherichia coli que se encuentra en la mezcla M-1 x R-1, está muy por debajo de la concentración de mezcla M-0 x R-1, quizá esto se deba deba al exceso de microorganismos en la mezcla M-1 x R-1 a la cual se le añadieron los MONA, lo que provoca una competencia entre especies y denota la superioridad de los microorganismos nativos. Posteriormente se observa que a las tres semanas de fermentación la concentración de los coliformes fecales es muy inferior respecto a los límites aceptados por la Norma Mexicana NADF-020-AMBT- 2011. Después de los tres meses de fermentación requerida, la cantidad de coliformes totales es escasa, descartando de esta manera la contaminación con microorganismos patógenos.
Tabla 8 Recuento de coliformes totales para las mezclas de biol mineralizado M0xR1 y M1xR1 al inicio del estudio, a las tres semanas y a los tres meses.
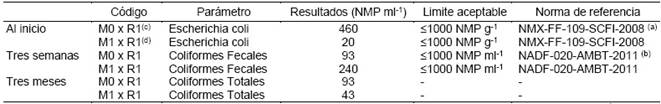
Comparación con la una norma mexicana a falta de una específica en nuestro país; a Según la norma NM X-FF-109-SCFI-2008; b Según la norma NADF-020-AMBT-2011; c M0xR1; Biol + andesita; d M1xR1; Biol + andesita + microorganismos nativos del Altiplano; NMP ml-1 = número más probable por mililitro.
Tres semanas después del inicio del proceso de fermentación se realiza el recuento de microorganismos estableciendo una dilución de 10-5 para las bacterias Mesofilas, Mohos y levaduras, que se presentan en la Tabla 9.
Tabla 9 Recuento de microorganismos presentes en las mezclas de biol mineralizado a las tres semanas de fermentación.

UFC ml-1 = Unidad formadora de colonia por mililitro; a MONA = microorganismos nativos del Altiplano.
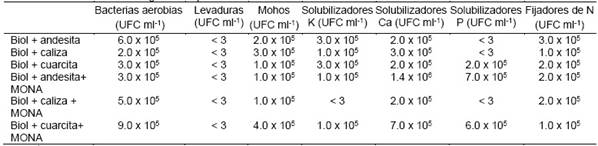
Posteriormente se realiza otro recuento de microorganismos a los tres meses de fermentación, que es cuando se procede con la prueba en los Biotest, estableciendo una dilución de 10-5 para el recuento de bacterias Mesofilas, mohos y levaduras, además de ellos se realizó un recuento de microorganismos específicos, fijadores de nitrógeno, solubilizadores de fósforo, solubilizadores de potasio y solubilizadores de calcio. Los resultados obtenidos se presentan en la Tabla 10. Se puede destacar que las mezclas biol + andesita + MONA y biol + cuarcita+ MONA que son las que mayor cantidad de microorganismos contienen.
Análisis costo beneficio
El costo de producción para 15 litros de biol mineralizado fue de 13.34 USD2, también se consideró 10 % por costo administrativos y 5 % por imprevistos asiendo un total de 15.33 USD. Además de ello se considera la adición de un 20 % para el valor bruto de producción. En ese sentido, el resultado de la relación beneficio/costo es 1.2, que siendo > 1 indica la viabilidad del proyecto, en caso de una posible comercialización.
Considerando los precios de los biofertilizantes comercializados en el mercado nacional (Tabla 11), destaca que el producto elaborado en este trabajo de investigación tiene un costo mucho menor, siendo el valor bruto de producción 1.23 USD por litro. Esto debido a que no se consideraron los costos fijos de producción y el costo de la adquisición de las rocas como materia prima, ya que estas fueron recolectadas en cercanías de la Estación Experimental Choquenaira. Sin embargo, cabe destacar que la producción local de los bioinsumos, en este caso del biol mineralizado, es una opción viable ya que para tal procedimiento se emplean materiales propios del lugar reduciendo ciertos costos.
CONCLUSIONES
Es posible producir un biofertilizante usando como base el biol y la adición de roca pulverizada (harina de rocas) y microorganismos nativos del altiplano (MONA) en la Estación Experimental Choquenaira. La preparación de las mezclas de biol mineralizado tomó un tiempo de tres meses, empleando en ello el biol que producen en el lugar, los microorganismos nativos del Altiplano (MONA) y las rocas andesita, caliza y cuarcita. Todos estos materiales se encuentran en proximidades de la Estación Experimental Choquenaira, facilitando de esta manera su traslado y elaboración.
Para evaluar la eficiencia de las mezclas de biol mineralizado se empleó el cultivo de lechuga crespa, seleccionada por su resistencia a las bajas temperaturas. En esta prueba tres de las cinco variables de respuestas fueron favorables para la mezcla M1xR1, que es la que contiene MONA y roca pulverizada de andesita. Además de las variables de respuesta se pudo observar que los biotest que fueron tratadas con las mezclas de biol mineralizado que contenían los MONA tenían cierta resistencia a las bajas temperaturas.
Se analiza la composición fisicoquímica, química y microbiológica de la mezcla M1xR1 (MONA + Andesita) destacando en ello la calidad del producto obtenido, al compararlo con los parámetros fisicoquímicos de la Norma Mexicana “Humus de lombriz” NMX-FF-109-SCFI-2008. En este sentido se puede destacar la relación C/N, la cual indica un alto contenido de nitrógeno. En el caso del análisis microbiológico se destaca el recuento de microorganismos específicos, como ser: fijadores de nitrógeno, solubilizadores de fosforo, solubilizadores de potasio y solubilizadores de calcio, siendo este último el que se encuentra con mayor abundancia.
Mediante el análisis costo-beneficio se logra demostrar que la producción de este tipo de biofertilizantes puede llegar a ser rentable, considerando que el costo de producción por litro alcanzó un monto de 1.23 USD por litro. Considerando su bajo costo y su elaboración sencilla es posible implementar estas técnicas en la agricultura familiar y comunitaria.