INTRODUCCIÓN
La población mundial cada vez es más mayor, lo que se refleja en una mayor demanda de alimentos (Camelo et al., 2011; Ramírez et al., 2020), según Pérez et al. (2018), para 2050 la población estimada será de 9.1 mil millones de habitantes. Esta demanda, obliga al uso de tecnologías como fertilización química, semillas mejoradas, entre otras, dando como resultado una “agricultura intensiva”, con alto consumo de plaguicidas y fertilizantes químicos y contaminación de suelos, laboreo excesivo del suelo, daños a la salud y pérdida de la fertilidad de los suelos (Moreno et al., 2018). Para contrarrestar los efectos negativos de la agricultura intensiva y el uso de plaguicidas, se aplica la agricultura amigable con el ambiente (Pešaković et al., 2013). En este contexto, una alternativa recomendada es el uso de fertilizantes a base de microorganismos benéficos (Rodríguez-Navarro y Ruíz-Sainz, 2010). Entre estos, las bacterias promotoras del crecimiento vegetal (PGPRs, por sus siglas en inglés “Plant Growth Promoting Rhizobacteria”) (Santoyo et al., 2021). Según Kloepper et al. (1989). Morales y Hernández (2023), reporta que las PGPRs están asociadas a la rizósfera en las plantas provocando múltiples beneficios. Entre estos, la disponibilidad y ayuda en la absorción de nutrientes y la producción de fitohormonas (Ucea-Herrera et al., 2020). Las auxinas como el ácido-3-indolacético (IAA), citoquininas y giberelinas que son las sustancias que mayor atención han recibido, habiéndose demostrado que diferentes géneros bacterianos las producen e inducen la germinación, mayor desarrollo de las raíces, favorecen la floración y la formación del fruto (Camelo et al., 2011; González y Fuentes, 2017).
Otra característica de las bacterias PGPR reportada por Ochoa et al. (2022), es la sintetización de diferentes enzimas; tales como, ácido 1-aminociclopropano-1-carboxílico (ACC) desaminasa encargada de la reducción de la concentración de etileno, que producen las plantas bajo condiciones de estrés (Contesto et al., 2008; Bal et al., 2013; Barnawal et al., 2017; Sarkar et al., 2018). La producción de sideróforos es otro modo en que las bacterias favorecen el desarrollo de las plantas a través de la disponibilidad del hierro (Heidarzadeh y Baghaee- Ravari, 2015). Otro efecto es el incremento de la disponibilidad del fósforo, mediante la solubilización del P orgánico e inorgánico (Trujillo et al., 2011). Además, estas promueven el crecimiento de las plantas mediante, el control de otros microorganismos patógenos (Singh et al., 2011; Gupta et al., 2021). En ese sentido estas pueden actuar mediante la producción de agentes antimicrobianos, lo que es un antagonismo directo sobre el patógeno, Resistencia Sistémica Inducida (RSI) en la propia planta (Harish et al., 2008; Singh, 2013; Gupta et al., 2021). La RSI se activa por la colonización de la superficie de las raíces por parte de las bacterias (Akila et al., 2011), activando sus defensas contra patógenos (Benjumeda, 2017).
Por estas características, estas bacterias son usadas como biofertilizantes y/o biocontroladores en diferentes cultivos (Moreno et al., 2018; Bigatton et al., 2020), incluido el banano (Marcano et al., 2016a y Marcano et al., 2016b; Moreno et al., 2018). El banano orgánico es afectado por la enfermedad Sigatoka negra causada por Mycosphaerella fijiensis Morelet llamada actualmente Pseudocercospora fijiensis (Vázquez- Euán et al., 2019). La cual afecta el área foliar de la planta, lo que disminuye el rendimiento y las características del fruto en el cultivo (Marín et al., 2003), generando preocupación entre los productores de banano para exportación de la Línea Noroeste y otras localidades (Polanco, 2008), igualmente, en otros países donde se cultiva el género Musa AAA (Manzo- Sánchez et al., 2014).
La Sigatoka negra es considerada la principal enfermedad que afecta al banano en la República Dominicana, la cual produce necrosis y muerte acelerada de las hojas, lo que genera una madurez precoz del fruto (Ceballos et al., 2012), reducción del peso y tamaño de la fruta, factores que contribuyen a su rechazo para fines de exportación. Esta enfermedad afecta a casi todas las plantaciones de musáceas del país (Polanco, 2008). Si las condiciones climáticas son favorables para el desarrollo de la enfermedad, el ataque podría ser devastador, amenazando así la sostenibilidad de los sistemas de producción (Céspedes, 2008). Las pérdidas en la productividad del cultivo son estimadas entre el 30 al 80 %, cuando no se realiza el manejo apropiado de la enfermedad (Polanco, 2008).
Debido a las diferentes exigencias de control de calidad para la exportacion del banano, en la República Dominicana se buscan alternativas para disminuir la incidencia de la Sigatoka negra y obtener frutas inocuas y de mejor calidad. Una de estas opciones es el uso de bacterias PGPRs como biofertilizantes y/o biocontraldoras del hongo. En ese sentido, se realizó la invetigación con el objetivo de usar bacterias autóctonas promotoras del crecimiento vegetal (PGPR) en el control de Mycosphaerella fijiensis en plantaciones de banano. La misma fue realizada en plantaciones comerciales de banano orgánico en fincas de productores de la Asociación Bananos Ecológicos de la Línea Noroeste (BANELINO, 2017), provincia de Montecristi.
MATERIALES Y MÉTODOS
Ubicación de la zona de estudio
Esta investigación se realizó en Hato del Medio, Distrito Municipal Hatillo Palma, provincia Montecristi, República Dominicana, Línea Noroeste, en una finca con una superficie de 22 ha y un área experimental de 0.15 ha. Las coordenadas UTM del área experimental fueron: 19.663742N - 71.209946W. Los suelos de la finca son de textura arcillosa, pH de 7.8 en CaCl2, una capacidad de intercambio catiónico efectiva (CICE) de 33.33 meq 100ml-1 de suelo, y un 1.93 % de materia orgánica. El clima de la provincia Montecristi es semiárido, con temperatura y precipitación promedio anual de 26.5 °C y 700 mm, respectivamente (Rodríguez et al., 2020).
Metodología
Selección de finca y material para ensayo
Se estableció una nueva plantación de banano en la finca del productor Domingo López Quezada. La siembra se realizó en el mes de febrero de 2019 y se utilizaron plantas in vitro de la variedad Cavendish (Gran enano), multiplicadas en el Laboratorio de Biotecnología de la Facultad de Ciencias Agronómicas y Veterinarias de la Universidad Autónoma de Santo Domingo (UASD). Las bacterias PGPRs inoculadas corresponden a cepas de colección identificadas y seleccionadas como promotoras del desarrollo y biocontroladores (Marcano, 2014; Tabla 1). Además, se utilizaron equipos convencionales de campo como machete, azadas, palas y coa.
Obtención de las bacterias e inoculación de plantas
Estos microorganismos fueron cultivados en laboratorio en medio artificial Tryptic Soy Agar (TSA) por 24 horas a 28 oC y luego transferidas a medio líquido de Tryptic Soy Broth (TSB); se dejaron crecer por cinco días obteniendo una concentración aproximada 6x108 unidades formadoras de colonias (UFC) por ml en UFC ml-1. Las plantas de banano fueron inoculadas con cepas bacterianas a razón de 20 ml planta-1 y una dosis única. La solución inoculada fue distribuida alrededor la cada planta, incluyendo la zona radicular, usando jeringas plásticas de 20 ml. Las plántulas fueron endurecidas en vivero por una semana, posterior a su inoculación y luego, fueron sembradas en campo. Las plantas fueron manejadas por el productor, según las exigencias para plantaciones orgánicas.
Manejo de la plantación y diseño experimental en la investigación
Se realizaron diferentes labores en el experimento, tales como construcción de drenajes en toda la parcela, pase de rastra y cruce, subsolado, corte, cruce y nivelación a láser 0.0 por terrazas y la construcción de muros en las orillas de las terrazas y los drenajes. Se usó un diseño experimental en bloques completos al azar con cuatro tratamientos y cuatro repeticiones, con un marco de plantación 2 m x 2.5 m; por cada tratamiento se establecieron 24 plantas y se evaluaron 10 plantas por tratamiento.
Variables medidas para la evolución de la Sigatoka negra
La evaluación en plántulas de banano se inició en la semana 15 después de plantado y con un desarrollo de 10 hojas verdaderas. Para el análisis del impacto de Sigatoka negra en las plantas de banano se tomaron datos semanales de los diferentes indicadores del estado evolutivo, según Stover (1980) modificada por Gauhl (1989) y citado por Orjeda (1998) y Morales et al. (2011), estos datos fueron: correctivo evolución (CE), suma Bruta (SB), suma evolutiva (SEV) y estado evolutivo (EE).
Los datos para la evaluacion de la evolucion de Sigatoka negra fueron recolectados en un formulario usado por BANELINO para llevar el control de la enfermedad en las plantaciones bananeras. Se realizaron dos evaluaciones durante el ensayo: una primera en la plantilla y otra a la planta sustituta. La toma de datos en la planta de banano finalizó una vez inicia la fructificación, ya que en esta fase deja de emitir hojas nuevas. Sin embargo, se continuó la evaluación en el hijo, que es el sustituto de la planta madre.
Para evaluar el desarrollo de las plantas de banano las variables medidas fueron: altura de la planta (AL) tomada desde la base de la planta hasta la base del pedúnculo de la última hoja totalmente abierta. Grosor del pseudotallo (PS) medida alrededor de la planta en la parte media tomando como referencia la medida desde la base de la planta hasta la base del pedúnculo de la última hoja totalmente abierta, estas variables se midieron con un centímetro (cm). El número de hojas (NH), aquí se contaba la cantidad de hojas abiertas. En la evaluación de la cosecha del banano se tomaron los siguientes parámetros: peso del racimo (Lb) tomada con una balanza, grado del dedo para el cual se midió el dedo central de la primera mano de abajo del racimo, utilizando un instrumento calibrado en milímetros, largo del dedo (cm) desde la base del fruto con el raquis hasta la punta de este, número de manos, número de hojas al momento de la cosecha, semana de cosecha, esta última se determina a partir del inicio de la inflorescencia.
Análisis de datos
Se empleó el Software estadístico Infostat (2018), para análisis estadísticos de los datos compilados en la investigación. Se realizó ANOVA, Test de Duncan con una probabilidad de 0.95 para las fuentes de variación que resultaron significativas y Análisis de Componente Principal (ACP).
RESULTADOS Y DISCUSIÓN
Evolución de la Sigatoka negra
El testigo tuvo mayor grado de infección por incidencia de la Sigatoka negra con relación a los demás tratamientos (Figura 1), siendo las variables CE, SB, SEV, EE más altas. La cepa codificada como MOSY21, identificada como P. plecoglossicida, muestra los mejores resultados sobre los demás tratamientos.
Los resultados encontrados son similares a los reportados por Marcano (2014); Marcano et al. (2016a y 2016b), estos reportan P. plecoglossicida con capacidad biocontroladora de Sigatoka negra. Mientras que, González (1995), realizó la búsqueda de microorganismos antagónicos a M. fijiensis en ensayos in vivo y obtuvo que los microorganismos indujeron un resultado positivo en el control de la enfermedad. Según Restrepo (2020), la disminución de la incidencia de la Sigatoka negra en las hojas del cultivo de banano, sugiere que las bacterias pueden inducir la resistencia en la expresión génicas en las plantas.
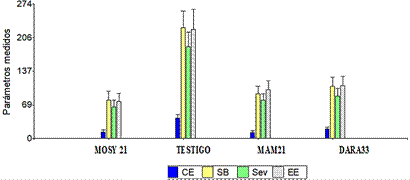
Figura 1 Evaluaciones de la incidencia de Sigatoka negra en campo de producción de banano, Hato del Medio con relación a correctivo evolución (CE), suma bruta (SB), suma evolutiva (SEV), estado evolutivo (EE).
Otro indicador de las diferencias significativas entre los tratamientos con bacterias y el testigo con respecto al estado evolutivo de la enfermedad, se presentan en las curvas mostradas en la primera evaluación realizada en el transcurso de desarrollo de las plantas (Figura 2). Se observa el testigo con mayor incidencia de la enfermedad en la semana de inicio de la evolución con un pico en la semana 41. La baja evolución de la incidencia de la enfermedad se puede atribuirse a la inducción de resistencia que pueden aportar las bacterias PGPR a las plantas. La inducción de resistencia es otra característica de las PGPR, según Posada (2017), aplicar bacterias PGPR produce un efecto de antagónico contra patógenos.
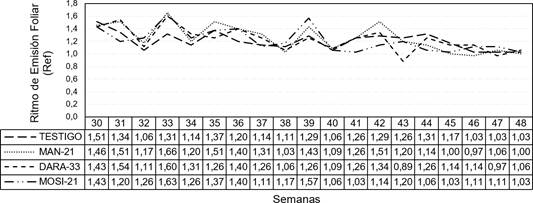
Los resultados para el ritmo de emisión foliar (Ref) durante las semanas de evaluación del ensayo para el desarrollo de la enfermedad Sigatoka negra desde la semana 30 hasta la 48, indican que los tratamientos bacterianos tienen mejor Ref en comparación con el testigo (Figura 3). El número de hojas en banano es un indicador de desarrollo de las plantas (Martínez et al., 2015; Castaño et al., 2021).
Indicadores de desarrollo de las plantas de banano
Los indicadores evaluados para el desarrollo de las plantas fueron Ref, AL, PS y NH, los tres tratamientos con bacterias poseen diferencias significativas con respecto al testigo (TEST) con relación a dichas variables, y no hay diferencias entre las cepas MOSY21 (P. plecoglossicida) y DARA33 (Bacillus licheniformis), según Tabl. Para la variable del número total de hojas por planta, los resultados indican que la bacteria MOSY21 mostró diferencias significativas con respecto a los demás tratamientos evaluados en el ensayo (Figura 4).
Tabla 2 Emisión foliar, promedio total de hojas, grosor del pseudotallo (cm) de las plantas de banano con la aplicación de tres bacterias y un control (n = 10).
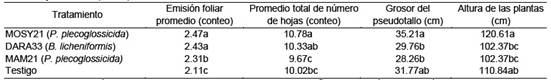
Medias con una letra común no son significativamente diferentes (p > 0.05); n= tamaño de la población; el error estándar en la prueba de Duncan fue de 0.04 para la emisión foliar, 0.2 para el promedio total de hojas, 1.39 grosor del pseudotallo y 4.95 para altura de plantas en todos los tratamientos.
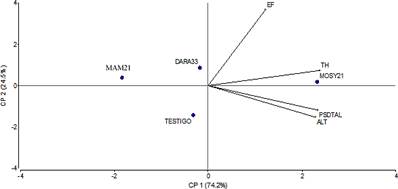
En relacion al grosor del pseudotallo, los resultados muestran a MOSY21 con diferencias significativas con respecto a los demás tratamientos con bacterias, no así con el testigo; en ese mismo orden, el testigo resultó igual a las demás bacterias (Tabla 2). En la altura de las plantas, muestra que MOSY21 tiene diferencias significativas con respecto a los demás tratamientos (Tabla 2). Al realizar análisis de componente principal (ACP), los resultados de las variables evaluadas para el desarrollo de las plantas se evidencia el buen comportamiento de la cepa MOSY21 (P. plecoglossicida), al estar todas las variables analizadas más cercanas a este tratamiento (Figura 4). Estos resultados coinciden con los obtenidos por otros investigadores, que muestran que las bacterias PGPRs produjeron un efecto positivo en el desarrollo de las plantas de banano y en otros cultivos (Díaz et al., 2001; Valencia y Valencia, 2008; Sánchez, 2011; Marcano et al., 2014).
Indicadores de la productividad del banano
En el análisis realizado para las semanas de cosecha del fruto no hubo diferencias significativas entre los tratamientos MOSY21, DARA33 y el testigo; sin embargo, se confirma que los tratamientos con bacterias fueron cosechados una semana antes comparado con el testigo. Para la variable del número de hoja al momento de la cosecha el tratamiento MOSY 21 tuvo diferencias significativas con respecto al testigo. El número de hojas tuvo diferencias significativas entre MOSY21 y el testigo (Tabla 3). Esta variable es importante al momento de la cosecha, ya que constituye un indicador de la calidad de la fruta a exportar.
Tabla 3 Semana de cosecha del racimo y número de hojas al momento de la cosecha de plantas de banano con la aplicación de tres bacterias y un control (n = 10).

Medias con una letra común no son significativamente diferentes (p > 0.05); n= tamaño de la población; el error estándar en la prueba de Duncan fue de 0.23 para la semana de cosecha del racimo y 0.36 para el número de hojas al momento de la cosecha en banano para todos los tratamientos.
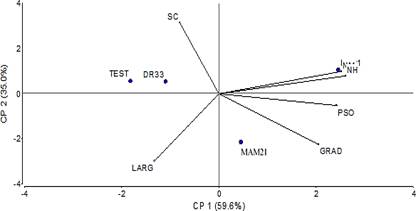
El análisis de componente principal de la evaluación del racimo muestra una tendencia con relación a un mejor comportamiento de los tratamientos MOSY21 y MAM21, los cuales arrojan los mejores resultados (Figura 5). Los resultados obtenidos en esta investigación son comparables con los reportados por otros autores en el cultivo de musáceas (Marcano, 2014; Chávez, 2016; Marcano et al., 2016a y 2016b; Terrero et al., 2020).
CONCLUSIONES
El uso de PGPRs en el cultivo del banano tiene potencial para promover una agricultura sostenible y aumentar la productividad de este cultivo. El uso de las bacterias PGPRs como biocontroladoras de la Sigatoka negra en el cultivo de banano y promotoras del desarrollo de las plantas superaron el comportamiento del testigo, siendo resultados con gran potencial para mejorar el control de la enfermedad y contribuir a un mejor rendimiento del banano. La cepa MOSY21 identificada como P. plecoglossicida, mostró el mejor resultado en cuanto a las variables evaluadas para el control de la enfermedad causada por Mycosphaerella fijiensis, así como en el desarrollo y la productividad de las plantas de banano, resultando con potencial para ser procesada, industrializada y puesta a disposición de los productores de banano orgánico. Estas bacterias pueden ser usadas para la agricultura orgánica con la finalidad de mejorar el desarrollo de las plantas de banano y su productividad. Al considerar que las PGPRs producen enzimas como: ácido 1-aminociclopropano-1-carboxílico (ACC) desaminasa, lo que contribuiría de forma positiva en una reducción de etileno y facilitaría el control de las enfermedades que ataquen al banano. Luego de concluida la fase uno del proyecto, se recomienda una segunda fase que incluya: 1. Enfatizar el potencial de las PGPRs en el control de la Sigatoka negra en el control de la enfermedad in situ; y 2. Explicar cómo las PGPRs interfiere en el ciclo de la vida del hongo Mycosphaerella fijensis.