Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Investigación & Desarrollo
versión impresa ISSN 1814-6333versión On-line ISSN 2518-4431
Inv. y Des. vol.1 no.17 Cochabamba 2017
http://dx.doi.org/10.23881/idupbo.017.1-1i
ARTÍCULOS–INGENIERÍAS
DESARROLLO DE UN MICROSCOPIO DE EPIFLUORESCENCIA DE BAJO COSTO
DEVELOPMENT OF A LOW-COST EPIFLUORESCENCE MICROSCOPE
Omar Ormachea1 y Alex Villazón2
Centro de Investigaciones Ópticas y Energías(CIOE)1
Centro de Investigaciones de Nuevas Tecnologías Informáticas (CINTI)2
Universidad Privada Boliviana
oormachea@upb.edu
(Recibido el 02 de mayo 2017, aceptado para publicación el 10 de junio 2017)
RESUMEN
La microscopía de epifluorescencia es una técnica poderosa con altos niveles de sensibilidad y resolución microscópica que se utiliza en varias áreas, particularmente en el campo biomédico.En este artículo se presenta el diseño y desarrollo de un microscopio de epifluorescencia de bajo costo basado en una fuente laser de excitación, un filtro barrera simplificado, y un sistema embebido (hardware y software) para la visualización y el control digital. El prototipo desarrollado utiliza un filtro barrera por absorción, basado en una solución de Rodamina 6G en alcohol etílico que absorbe de manera efectiva la radiación del láser de excitación y deja pasar la señal fluorescente de la muestra de interés. El poder de aumento del microscopio desarrollado es 100Xaproximadamente y permite identificar partículas fluorescentes del orden del 10 mm. Los resultados obtenidos con el prototipo desarrollado, muestran su viabilidad para unpotencialuso en aplicaciones biomédicas.
Palabras clave: Microscopía de Epifluorescencia, Sistemas Embebidos, Excitación Láser.
ABSTRACT
The epifluorescence microscopy is a powerful technique with high levels of sensibility and microscopic resolution that is applied in several areas, notably in the biomedical field.In this article, we present the design and development of a low-cost epifluorescence microscope based on laser excitation, a simplified barrier filter, and an embedded system (hardware and software) for digital visualization and control. The proposed prototype uses an absorption barrier filter based on a Rhodamine 6G dye solution (in ethylic alcohol), capable of absorbing effectively the laser excitation radiation and transmitting the fluorescence signal of the sample. The optical magnification of the prototype is around 100X and allows identifying fluorescent microparticles (~10 mm). The encouraging results obtained with the prototype, show its viability and potentiality for biomedical applications.
Keywords: Epifluorescence Microscopy, Embedded Systems, Laser Excitation.
1. INTRODUCCIÓN
La Microscopía de Fluorescencia permite estudiar materiales fluorescentes, ya sea de manera natural (materiales autofluorescentes) o tratados con elementosfluorescentes.La microscopía de fluorescencia es una técnicapoderosacon altos niveles de sensibilidad y resolución microscópica que se utiliza en varias áreas, como ser la petrología de carbón [1], la identificación de contaminantes en ciencia de materiales [2], la inspección de semiconductores [3], la ingeniería medio-ambiental (estimación de calidad de agua) [4], y siendo una herramientamuy importante para la biología celular y el diagnóstico clínico (e.g., inmunología, patología, microbiología)[5-7].
En este artículo se describe el desarrollo de un microscopio de fluorescencia de bajo costo, basado en una fuente de luz láser y un esquema simplificado de filtraje de la señal de emisión, que, a diferencia de los microscopios de fluorescencia convencionales, no utiliza espejos dicroicos (cubos para filtros de fluorescencia) ni requiere de filtros de excitación. Además, el prototipo desarrollado incluye una cámara digital acoplada a unsistema embebido que puede enviar las imágenes obtenidas a cualquier dispositivo (teléfono inteligente, tableta o computador) de manera inalámbrica.
El resto del artículo está estructurado de la siguiente manera: La Sección 2 presenta el principio de funcionamiento de un microscopio de epifluorescencia. La Sección 3 describe en detalle el diseño, pruebas preliminares, desarrollo del prototipo y el software de control y visualización, incluida una estimación de costo. Los resultados obtenidos del poder de aumento del microscopio desarrollado y la detección de la fluorescencia de micropartículas son presentados en la Sección 4 y la Sección 5 presenta las conclusiones.
2. PRINCIPIO DE MICROSCOPÍA DE EPIFLUORESCENCIA
La fluorescencia es un fenómeno de luminiscencia [8], propiedad de ciertos elementos químicos denominados fluorocromos ofluoróforos.El fluorocromo es utilizado como un marcador colorante fluorescente para crear contraste en zonas determinadas de elementos de interés (desde simples moléculas hasta microorganismos).El fluoróforo es una parte de una molécula (fluorocromo, proteína) que tiene propiedad de fluorescencia, i.e. que absorbe fotones con longitudes de onda cortas y emite fotones con mayores longitudes onda. La Figura 1 muestra el espectro de absorción de una substancia fluorescente y su respectivo espectro de emisión que está desplazado a mayores longitudes de onda.

Figura 1 - Espectros de absorción y emisión de substancias fluorescentes adaptada de [9].
Los microscopios de epifluorescenciase caracterizan por la formación de imágenes amplificadas, donde la muestraa ser analizada es iluminada con luz incidente y la luz reflejada es la que forma la imagen. Estos microscopios generalmente utilizan lámparas halógenas de alta potencia (~300 Watts) de luz blanca. La luz procedente de la fuente, atraviesa un primer filtro que selecciona la longitud de onda necesaria para excitar al fluorocromo (espectro de absorción). Esta luz se refleja en un espejo dicroico e incide sobre la muestra, excitando alfluorocromo, el que emite fotones de una longitud de onda mayor que la luz incidente. La luz emitida (espectro de emisión), atraviesa el espejo dicroico y llega un segundo filtro que deja pasar únicamente la longitud de onda de emisión del fluorocromo (ver Figura 2).

Figura 2 - Esquema de funcionamiento de un microscopio de epifluorescencia
3. DESARROLLO DEL MICROSCOPIO DE EPIFLUORESCENCIA CON FUENTE LASER
La mayoría de los microscopios de epifluorescencia convencionales utilizan lámparas halógenas de alta potencia, donde solo una fracción muy pequeña del espectro emitido es utilizada como señal de excitación, lo cual influye en la intensidad de la señal de fluorescencia (a mayor señal de excitación, mayor contraste y por ende mayor costo).Para mejorar este esquema ineficiente,puesto que se emplea una lámpara de luz blanca de alta potencia, se propone reemplazarla por una fuente láser monocromática (más intensa y de menor consumo energético).
3.1. Diseño del microscopio
Para el prototipo propuesto, se seleccionó una fuente láser continua de 532 nm (rango visible) de 5mW hasta 100 mW de potencia regulable, para el cual existe una variedad de fluorocromos que pueden ser excitados con esta longitud de onda. El esquema propuesto tiene la ventaja de prescindir del filtro de excitación y del espejo dicroico (ambos elementos ópticos especiales de alto costo), requiriendo sólo del filtro de barrera.
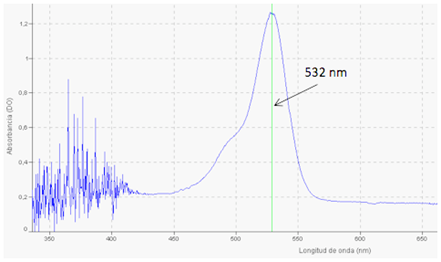
Para el desarrollo del filtro de barrera, se propone utilizar el colorante Rodamina 6G [10]diluido en alcohol etílico. La Rodamina 6G tiene un pico de absorción de 532 nm que corresponde a la longitud de onda de emisión del láser propuesto (ver Figura 3). Adicionalmente, la posibilidad de usar diferentes concentraciones en la solución, permite obtener diferentes densidades ópticas[1] para optimizar el filtraje de la señal de excitación con respecto a la señal de fluorescencia (contraste).
| Figura 3 | Espectro de Absorción de Rhodamine-6G diluida en alcohol etílico, medido con un espectrómetro Ocean Optics STS-VIS. |
En la Figura 4 se observa el esquema completo del microscopio de epifluorescenciapropuesto. Este cuenta conlas siguientes partes:
● Sistema óptico de amplificación: Está conformado por un objetivo especial focalizable, un ocular acoplado a una cámara digital de 8MP de un dispositivo embebido RaspberryPi3[2]. La amplificación estimada del microscopio desarrollado es de 100x a 150x (sin amplificación digital).
● Filtro de barrera: El filtro de barrera(cubeta con solución de Rodamina-6G en alcohol etílico) se encuentra delante del objetivo ocular y permite filtrar completamente la señal de excitación (532 nm).
● Sistema de iluminación: Para la focalización del sector de visualización de las muestras (antes de la emisión laser), se utiliza un LED blanco comercial con control electrónico de intensidad.
● Fuente de excitación láser: La fuente de excitación láser está conformada por un controlador electrónico de 12 VDC, un cabezal láser semiconductor (diodo)focalizable que emite en forma continua en una longitud de onda de 532 nm y una potencia máxima de 100 mW.
● Sistema electro-mecánico de posicionamiento: Está conformado por un posicionador X-Y de microscopio (X-Y mechanicalstage) para el posicionamiento de muestras en portaobjetos de microscopio convencionales (placas de vidrio de 75x25mm).Al posicionador X-Y se le adaptó un sistema electro-mecánico de posicionamiento automatizado basado en 2 motores de paso de alta precisión.
● Hardware de visualización y control: El sistema de visualización y control está conformado por un dispositivo embebido RaspberryPi3 que es un mini-computador completo de tamaño reducido y bajo costo (~35 USD) que utiliza software abierto. El dispositivo tiene relativo alto poder de procesamiento gracias a un procesador con 4 núcleos ARM-Cortex de 1.2 GHz, lo que permite el procesamiento de imágenes y el desarrollo de aplicaciones embebidas. Además, cuenta con puertos analógicos y digitales para la conexión con otros elementos electrónicos (sensores, motores de paso, etc.), conectores para cámaras de alta definición de 5MP u 8MP e interface Wifi incorporado.
● Software de visualización y control: El software de visualización y control es una aplicación Web, donde la parte servidor se ejecuta en el dispositivoRaspberryPi3 y la parte cliente se ejecuta en un navegador Web convencional.La aplicación captura las imágenes de la cámara, las procesa y envía a cualquier dispositivo conectado a la red Wifi propia controlada por el dispositivo RaspberryPi3. La aplicación Web también permite el control de los motores de paso, la intensidad del LED blanco y la intensidad del láser. Esto permite utilizar cualquier laptop, tableta o teléfono inteligente para visualizar y controlar el microscopio desarrollado, utilizando un navegador Web, sin necesidad de contar con un computador dedicado ni software especialinstalado.

Figura 4 - Esquema del dispositivo para microscopia de fluorescencia de bajo costo.
El microscopio de fluorescencia con fuente láser desarrollado puede ser totalmente autónomo en energía, ya que solo se requiere energía para alimentar el dispositivo RaspberryPi3 (5VDC/2A), el láser (12VDC/0.5A) y el sistema de posicionamiento (5VDC/1A), para lo cual una batería de litio recargable de 12V es suficiente.
3.2. Pruebas preliminares y desarrollo del filtro barrera
Durante las pruebas preliminares en laboratorio, se montaron los componentes del microscopio de epifluorescencia propuesto en una mesa óptica en elementos opto-mecánicos de precisión, como muestra la Figura 5(a).
| Figura 5 | (a) Microscopio de Fluorescencia con fuente Láser en pruebas de laboratorio, (b) Pruebas con filtro barrera (solución de Rodamina 6G en cubeta de vidrio) que absorve completamente la radiación láser (532 nm). |
Para el desarrollo del filtro barrera se utilizó una solución de Rodamina 6G en alcohol etílico en una cubeta de vidrio. Este filtrobarrera tiene un pico de absorción en 532 nm que corresponde a la longitud de onda del láser utilizado como fuente de excitación (color verde), lo que permite bloquear completamente la señal láser como se observa en la Figura 5(b). La ventaja de utilizar un filtro barrera en una solución es que, si se aumenta la intensidad de la señal de excitación láser, se puede variar la densidad óptica del filtro cambiando la concentración de Rodamina 6G. Para la obtención de la densidad óptica óptima que bloquee completamente la radiación láser con una intensidad de 100 mW, se diluyeron diferentes concentraciones de polvo de Rodamina 6G en alcohol de alta pureza al 99%, encontrando el valor óptimo de la densidad óptica de 2.8, medido con un espectrómetro OceanOptics STS-VIS[3].
En la Figura 6 se muestra los espectros de absorción y emisión característicos de una solución de Rodamina 6G en alcohol etílico, cuyo ancho espectral de absorción corresponde al rango de 500-550 nm(con un pico de absorción de 532 nm) y ancho espectral de emisión corresponde al rango de 555-585 nm (con un pico de emisión de 566 nm correspondiente al color anaranjado).

Figura 6 - Espectros de emisión y absorción de una solución de Rodamina 6G en alcohol etílico.
El funcionamiento del microscopio de epifluorescencia propuesto es como sigue:
● Se coloca la muestra microscópica de interés que contiene algún fluorocromo o fluoróforo de interés en un portaobjetos de vidrio y se ilumina con un LED blanco de alto brillo.
● Se obtiene la imagen amplificada de la muestra de interés en la cámara digital a través del sistema óptico de amplificación y se procede a la focalización mecánica del objetivo principal del microscopio.
● Se procede a insertar el filtro barrera por delante del ocular del microscopio, se desconecta la luz LED y se dispara el láser hacia la muestra.
● La imagen capturada por la cámara en estas condiciones solo detecta la señal fluorescente (de color anaranjado) de la muestrade interés, filtrando completamente la señal láser de excitación y cualquier otra señal que se encuentre fuera del rango de transmisión del filtro barrera.
Una vez realizadas las pruebas de laboratorio, se procedió al diseño del prototipo funcional de microscopio de epifluorescencia propuesto.
3.3. Desarrollo del prototipo funcional
Se construyó un prototipo funcional de microscopía de fluorescencia con fuente láser montado en una estructura mecánica modular compuesta por accesorios de soporte metálicos que permiten alinear todos los elementos ópticos, electro-mecánicos, de iluminación, de posicionamiento X-Y y de excitación láser del microscopio. La estructura metálica tiene peso aproximado de 3Kg y mide 25x25x15cm, haciendo de este dispositivo un elemento robusto y transportable. Como muestra la Figura 7, todos los elementos del microscopio están ensamblados de manera compacta. Para reducir la distancia entre el objetivo focalizable y el objetivo ocular (alrededor de 40 cm), se utilizaron dos prismas para armar un camino óptico en forma de U como muestra la vista superior en la Figura 8 (a) y un tercer prisma para poder reflejar la imagen de la muestra posicionada de manera horizontal como muestra la vista lateral de la Figura 8 (b).

Figura 7 - Prototipo del microscopio de epifluorescencia y aplicación Web de control y visualización.

Figura 8 - (a) vista superior y (b) vista lateral del esquema óptico del microscopio.
3.4. Desarrollo del software de control y visualización
Los microscopios de epifluorescencia comerciales son utilizados generalmente para observación directa a través de los oculares del microscopio. Algunos microscopios permiten digitalizar las imágenes usando cámaras especiales que requieren software instalado en un computador externo y se conectan al microscopio por cable(e.g. vía USB).Esto requiere alineamiento y calibración de la cámara por personal especializado y material electrónico adicional, lo que resulta en un aumento de costos.
Para evitar la problemática antes mencionada, se implementó una aplicación Webaccesible desde cualquier dispositivo con conexión Wifi (smartphones, tablets, laptops, etc.). Laparte servidor de laaplicación Web se ejecuta en el dispositivo RaspberryPi3 y se utiliza la antena Wifi integrada en el dispositivo para convertirlo en un punto de acceso (Access Point) Wifi creando una red local i.e. cuando el dispositivo se inicializacrea una red Wifi propia a la que se pueden conectar otros dispositivos.Se debe enfatizar que la red local Wifi creada no está conectada a Internet, lo que permite utilizar el microscopio independientemente de tener a disposición un acceso a Internet.
La ventaja de utilizar un sistema embebidoRaspberryPi3 es su tamaño reducido, antena Wifi incorporada, conector de cámara digital de alta definición incorporada CSI (Camera Serial Interface), bajo costo y bajo consumo energético. Sin embargo, estos dispositivos tienen ciertas limitantes en poder de procesamiento, memoria y acceso al flujo de video de la cámara conectada al dispositivo a través de su puerto CSI. Por ejemplo, para enviar las imágenes capturadas de la cámara a una página Web, es necesario tener dos procesos separados: uno que lee las imágenes y las procesa para comprimirlas de su formato original de alta definición al formato JPEG (P1) y el otro que ejecuta el servidor Web (P2).Para realizar una comunicación eficiente entre ambos procesos, es necesario evitar que la cámara grabe las imágenes en el disco duro del dispositivo (tarjeta SD), puesto que la lectura/escritura es lenta. Por esta razón, la aplicación desarrollada está basada en una arquitectura optimizada de captura de imágenesyenvío de flujo de video a una página Web utilizando la memoria RAM internadel dispositivo, que es mucho más rápida que la tarjeta SD[4]. Para esto, el proceso P2ejecuta código que lee directamente la imagen de la cámara a través de la interface MMAL (Multi-Media AbstractionLayer) y las escribe directamente en memoriacompartida RAM (utilizando un fichero virtual).El proceso P2 lee lasimágenesde la memoria compartida y las envía los clientes Web en flujo continuo (i.e. a todo dispositivo conectado). Asimismo, la aplicación Web permite modificar los parámetros de la cámara (luminosidad, contraste, autofoco, brillo, etc.) de manera inalámbrica directamente desde cualquier cliente Web.
El control de los motores de paso se realiza directamente desde la aplicación Web de manera inalámbrica. Las solicitudes de desplazamiento en las coordenadas X-Y del posicionador que contiene al portaobjetos, son enviadas desde el navegador Web al servidor que se ejecuta en el RaspberryPi a través de un canal de comunicación WebSocket[5]. El servidor procesa la solicitud y envía los comandos de rotación al controlador electrónico de los motores de paso para realizar el desplazamiento correspondiente. La Figura 9 muestra el esquema completo de funcionamiento del software que se ejecuta en el dispositivo embebido RaspberryPi 3, donde se observa la captura y procesamiento de imágenes en alta definición, la comunicación entre procesos P1 y P2, el envío de imágenes JPEG al cliente Web, y la comunicación para comandos de control a los motores de paso para el posicionamiento automático.
| Figura 9 | Esquema de funcionamiento del software de control y visualización en el dispositivo embebido RaspberryPi 3. |
3.5. Estimación del costo del prototipo
El diseño del prototipo del microscopio de epifluorescenciapermite reducir los costos de desarrollo e implementación gracias al uso de elementos comerciales y de fácil acceso. El costo de los componentes ópticos, electrónicos e insumos utilizados para la implementación del prototipo propuesto, es deaproximadamente 620 USD (ver detalle en TABLA 1), que es muy inferior comparado con un microscopio de fluorescencia convencional digital (e.g.OlympusIX53[11], Motic-BA410 Epi [12]), con costos superiores a los 20.000 USD. Adicionalmente, el prototipo desarrollado tiene la ventaja de ser un dispositivo portátil, permitiendo su uso en lugares alejados, y también puede ser utilizado para fines educativos (entrenamiento en óptica médica).
TABLA 1: ESTIMACIÓN DE COSTOS DE COMPONENTES UTILIZADOS PARA EL PROTOTIPO DE
MICROSCOPÍA DE EPIFLUORESCENCIA
| Componente utilizado | Cantidad | Costo estimado (USD) |
| Laser de 100 mW (532 nm) | 1 | 60 |
| RaspberryPi 3 (kit) | 1 | 70 |
| Objetivo Ocular | 1 | 65 |
| Objetivo Focalizable | 1 | 95 |
| Posicionador X-Y | 1 | 20 |
| Cámara RaspberryPi 8MP | 1 | 30 |
| Estructura metálica | 1 | 80 |
| Cubeta de vidrio | 1 | 5 |
| Batería Ion Litio 12VDC | 1 | 30 |
| Rodamina 6G (1 gr) | 1 | 15 |
| Controlador de motor de paso | 2 | 25 |
| Motores de paso | 2 | 30 |
| Prismas | 3 | 75 |
| Accesorios electrónicos |
| 20 |
|
| TOTAL | 620 |
Para la caracterización del poder de aumento del microscopio desarrollado, se utilizó un patrón estándar de calibración de amplificación (microscopecalibrationslide) que es un portaobjetos de vidrio donde se tiene impresa una escala de medida métrica correspondiente a 1mm dividido en 100 partes (10-5 m). En la Figura 10a se observa la captura de imagen del patrón de escala obtenida directamente por el microscopio, en la Figura 10b la comparación de la imagen original (sin zoom digital) con una regla de 10 cm, confirmando que la amplificación óptica del microscopio corresponde a 100x. Adicionalmente, la aplicación Web permite realizar una amplificación digital adicional de 3x.
| Figura 10 | Caracterización del poder de aumento del microscopio desarrollado 100x (a) imagen con un patrón de referencia de tipo“microscope calibration slide” (0.01 mm) y (b) comparación de la imagen sin zoom digitalcon una regla de 10 cm. |
Para la validación del prototipo se utilizaron partículas microscópicas de Rodamina 6G por sus características ópticas de absorción y fluorescencia, i.e. la Rodamina 6G diluida es utilizada como filtro barrera, y la Rodamina 6G en polvo es utilizada como fluoróforo de muestreo, ya que tiene un pico de absorción máximo en 532 nm(que corresponde a la fuente láser de excitación del dispositivo) y un rango de emisión fluorescente de 555-585 nmcorrespondiente al color anaranjado (ver Figura 6). Las partículas de polvo de Rodamina 6G fijadas en un portaobjetos de vidrio, fueron observadas con el microscopio desarrollado, con y sin excitación láser. La Figura 11a muestra una imagen amplificada por el microscopio únicamente iluminada con un LED blanco, donde se observan partículas dispersas, sin poder identificar aquellas de Rodamina 6G. Una vez la fuente de láser activada, claramente se observan partículasfluorescentesde Rodamina 6G de diferentes tamaños y fluorescencia anaranjada, como muestra la Figura 11b, confirmando que el filtro barrera bloquea completamente la radiación verde característica del láser de excitación y dejando pasar la luz de emisión de fluorescencia del fluoróforo utilizado.
| Figura 11 | Imagenes capturadas con el microscopio de epifluorescencia de particulas solidas de Rodamina 6G (a) sin excitación láser y (b) con excitación láser (fluorescencia en color anaranjado). |
Una vez identificadas las partículas fluorescentes del fluoróforo, se procedió a estimar las dimensiones de las mismas. En la Figura 12 se observan partículas de dimensiones del orden los 50 mm (1) y de 10 mm (2), sin fluorescencia Figura 12 (a) y con fluorescencia Figura 12 (b). Esta medición, confirma que el prototipo desarrollado, permite la identificación de partículas fluorescentes, de hasta 10 mm.

| Figura 12 | Resolución del microscopio de epifluorescencia de particulas solidas de Rodamina 6G (a) sin excitación láser y (b) con excitación láser (fluorescencia en color anaranjado). |
Los resultados obtenidos en la detección de fluorescencia y el poder de aumento del microscopio desarrollado, muestran su viabilidad para su uso en aplicaciones biomédicas. Un ejemplo de aplicación posible, es el conteo de células o bacterias marcadas con fluorocromo [13,14]que se podría realizar haciendo un barrido en X-Y de la muestra, utilizando el sistema de posicionamiento automático y procesamiento de imágenes para identificación de objetos, obteniendo resultados similares a los de un citómetro. Otro ejemplo de posible aplicación,es la detección de parásitos del TrispanosomaCruzi (T. cruzi), causante de la enfermedad del Mal de Chagas,para el cual se utiliza técnicas de inmuno-fluorescencia indirecta (IFI)[15].Si bien el microscopio propuesto no permitiría observar los parásitos en detalle (con un tamaño del orden de los 10-20 mm), la detección de fluorescencia bastaría para confirmar la presencia de agentes infecciosos y así diagnosticar casos positivos de Mal de Chagas.
En el presente trabajo se logró desarrolló un prototipo funcional de un microscopio de epifluorescenciaportátil de bajo costo. A diferencia de microscopios de epifluorescenciaconvencionales, el prototipo desarrollado utiliza una fuente de excitación láser compacta, monocromática (532 nm) y de alta intensidad, evitando así el uso de filtros de excitación. Asimismo, en la parte de la generación de imágenes fluorescentes, el sistema de filtraje fue simplificado al utilizar un filtro barrera por absorción basado en una solución de Rodamina 6G, a diferencia de los microscopios convencionales que utilizan cubos para filtros de fluorescencia con espejos dicroicos de costos elevados. La solución de Rodamina 6G en alcohol etílico utilizada es altamente absorbente para la longitud de onda del láser de excitación, obteniéndose una densidad óptica óptima de 2.8 para la potencia de láser de 100 mW utilizado. El poder de aumento del microscopio desarrollado es de 100x, estimada con un patrón estándar de calibración (microscopecalibrationslide). La validación del prototipo se realizó utilizando partículas microscópicas fluorescentes de Rodamina 6G, donde se lograron identificar partículas fluorescentes de hasta 10 mm.
El prototipo desarrollado cuenta con un sistema de control y visualización simplificado, basado en un dispositivo embebido RaspberryPi3 que ejecuta una aplicación Web que permite enviar un flujo de video capturado por la cámara del microscopio a cualquier dispositivo conectado a una red local Wifi propia del RaspberryPi3. Adicionalmente, la aplicación Web permite controlar de manera inalámbrica los parámetros de la cámara (luminosidad, contraste, autofoco, brillo, etc.) y sistema de posicionamiento electro-mecánico del portaobjetos que contiene la muestra a ser analizada.
Los resultados obtenidos muestran la viabilidad de uso del prototipo del microscopio desarrollado para aplicaciones en biomedicinapara la detección de enfermedades infeccionas a través de la técnica de inmuno-fluorescencia indirecta (IFI), por ejemplo para la detección del Mal de Chagas.
6. AGRADECIMIENTOS
Los autores agradecen la colaboración de Grover Zurita, investigador de la Universidad Privada Boliviana, en el diseño y construcción de la parte mecánica del prototipo.
7. BIBLIOGRAFÍA
[1] J. C. Crellin, «Current uses of fluorescence microscopy in coal petrology,» Journal of Microscopy, Vol. 132, Nº 3, pp. 251-266, 1982.
[2] A. Rodriguez, M. San Miguel, L. Escudero, V. Ruiz de Argandoña, L. Suarez del Rio «Aplicación de la microscopía óptica de fluorescencia al estudio textural del clinker de cemento portland,» Materiales de Costrucción, Vol. 37, Nº 205, pp. 17-22, 1987.
[3] P. M Farias, B. S. Santos, A. Fontes, and C. L. Cesar, «Semiconductor nanocrystals and fluorescence microscopy in biological labeling,» Microscopy,Vol. 1, pp. 840-847, 2007.
[4]J.E. Hobbie, R.J. Daley, and S.Jasper, «Use of nucleopore filters for counting bacteria by luorescence microscopy,»Applied Environmental Microbiology,Vol. 33, Nº 5, pp. 1225-1228, 1977.
[5]H. R. Petty, « Fluorescence microscopy: established and emerging methods, experimental strategies, and applications in immunology,»Microscopy research and technique,Vol. 70, Nº 8, pp. 687-709, 2007.
[6]M. Ragazzi et. al., «Fluorescence confocal microscopy for pathologists,» Modern Pathology, Vol. 27, pp. 460-471, 2014.
[7]Z.Gitai, « New Fluorescence Microscopy Methods for Microbiology: Sharper, Faster, and Quantitative,»Current Opinion in Microbiology, Vol. 12, Nº 3, pp. 341-346, 2009.
[8] J.R.Lakowicz,Principles of Fluorescence Spectroscopy,Springer Science & Business Media, 2007 [ Links ]
[9] W. A. Shirley, C. Handley, S. Bryant and M. Hall, «Quantitation of Immunoglobulin E Using Fluorescence Assay,» The Chemist, Vol. 82, Nº 2, pp. 1-7, 2014.
[10]R. Vogel, P. Meredith, M.D. Harvey, H. Rubinsztein-Dunlop, «Absorption and fluorescence spectroscopy of Rhodamine 6G intitanium dioxide nanocomposites,» Spectrochimica Acta Part A, Vol. 60, pp. 245-249, 2004.
[11] Olympus Corporation, « Microscopio invertido IX53 Microscopio invertido modular para trabajos de rutina,» 2017. [On-line]. Available: http://www.olympus-lifescience.com/es/microscopes/inverted/ix53/ [Last access: may 2017]. [ Links ]
[12] Motic, « Microscopio invertidoBA410 Epi,» 2017. [On-line]. Available:http://www.motic.com/Am_Accessories_LS_Fluore/view_666.html[Last access: may 2017]. [ Links ]
[13] J. Lojk,U. Čibej,D. Karla,L. ajn,M. Pavlin, « Comparison of Two Automatic Cell-counting Solutions for Fluorescent Microscopic Images,» Journal of Microscopy, Vol. 260, Nº 1, pp. 5343-5348, 2004.
[14] J. T. Lisle, M. A. Hamilton, A. R. Willse, and G. A. McFeters, « Comparison of Fluorescence Microscopy and Solid-Phase CytometryMethods for Counting Bacteria in Water,» Applied and Environmental Microbiology, Vol. 70, Nº 9, pp. 107-116, 2015.
[15]C. Enciso, et.al., «Comparación de la prueba de inmunofluorescencia indirecta, un inmunoensayo enzimático y la prueba comercial Chagatek® para la detección de anticuerpos anti- Trypanosoma cruzi,» Biomédica, Vol. 24, Nº 1, pp. 104-108, 2004.
Notas
[1]La densidad óptica o absorbancia se define como la relación logarítmica entre la intensidad de la luz que incide sobre una muestra y la intensidad de esa misma luz que es transmitida a través de esa muestra. La absorbancia es proporcional a la concentración de la sustancia diluida en la muestra.
[2] https://www.raspberrypi.org/products/raspberry-pi-3-model-b/
[3] https://oceanoptics.com/product/sts-developers-kit/
[4]http://elinux.org/RPi-Cam-Web-Interface