Introducción
En el mundo existen aproximadamente 20.000 especies de abejas reconocidas, de las cuales la mayoría son solitarias (Orr et al. 2021). La importancia de este grupo consiste en que son las principales polinizadoras de las angiospermas y, en particular, las hembras son las que cobran mayor notabilidad, ya que estas son las que construyen los nidos, colectan el polen y el néctar (Porto et al. 2020).
A pesar de ello, en Bolivia el conocimiento que se tiene sobre las abejas es muy pobre, dado que la mayoría de los estudios están centrados en la especie introducida Apis mellifera, debido a que son generalistas y producen miel, por lo que tienen mayor uso económico (Martinez, 2022). Sin embargo en las últimos años se han realizado más estudios en abejas nativas, en especial las abejas sin aguijón de la tribu Meliponini, de las cuales se tiene registro de 102 especies para nuestro país.
Estas abejas generan un importante servicio ecosistémico en los bosques tropicales. Aun así el conocimiento que se tiene sobre las abejas nativas bolivianas siguen siendo muy escaso (Adler, 2022; Santos, 2023).
Las abejas con hábitos nocturnos o crepusculares, generalmente denominadas abejas nocturnas, cuentan con un registro sumamente escaso. En todo el mundo se conocen 250 especies, de las cuales la mayoría se encuentra en regiones neotropicales (Cordeiro, et al., 2021).
Gran parte de las abejas nocturnas se encuentra dentro de la familia Halictidae como Megommation, Rhinetula (Halictini) y Megalopta (Augochlorini), el cual es el género más abundante con 32 especies registradas desde el sur de México a Argentina.
Este género cuenta con el mayor registro con respecto a su comportamiento, e incluso se ha propuesto que son polinizadores importantes de árboles como Ceiba y Pseudobombax (Wcislo, et al., 2004). Por otro lado, existen abejas nocturnas en otras familias como Ptiloglossa y Zikanapis de la familia Colletidae y algunas especies del género Xylocopa, como también un comportamiento facultativo nocturno de Apis dorsata y Apis mellifera de la familia Apidae (Michener, 2007; Cordeiro, et al., 2021).
Los bosques tropicales y sus interacciones toman importancia para la evolución de estas especies de abejas, debido a que el 99% de la polinización es por acción de insectos y aves, por lo cual las plantas han desarrollado recompensas en forma de néctar o polen para estos animales, formando diferentes nichos disponibles (Rumiz, 2001).
La competencia que se genera en los bosques podría favorecer que los individuos ocupen diferentes nichos ecológicos. Por eso se ha planteado la hipótesis de que las abejas nocturnas desarrollaron estos hábitos para no competir por los recursos florales con abejas diurnas (Wcislo, et al., 2004; Cordeiro, et al., 2021).
Por ejemplo, Megalopta genalis posee adaptaciones retinianas y ópticas 27 veces más sensibles a la luz que las abejas diurnas. Por otro lado, el hábito nocturno permite evitar enemigos como los cleptoparásitos que suelen ser menos activos durante la noche (Greiner, 2004; Cordeiro, et al., 2021).
Las interacciones planta-polinizador son consideradas una de las interacciones más particulares y complejas que existen, debido a que juegan un papel crucial en la conservación y el funcionamiento ecosistémico, por lo que en los últimos años se desarrollaron técnicas para estudiar estas redes de interacción.
Sin embargo las aproximaciones a estas redes complejas siguen siendo insuficientes (Jordano et al., 2009; del Val de Gortari, 2022). Las redes de interacción posibilitan estudiar cómo las especies que conviven en un solo lugar interactúan o se asocian entre sí, permitiendo el conocimiento de especies clave para el funcionamiento de un ecosistema, por lo tanto, nos permite comprender fenómenos como la extinción, invasión, disturbios naturales o perturbaciones antropogénicas (Beltrán y Traveset, 2018; Delmas et al., 2019)
El objetivo del estudio es construir una red de interacción insecto-planta desde el enfoque zoocéntrico para conocer la intensidad y características de la red entre abejas nocturnas y plantas locales correspondientes a un bosque de transición de Amazonia y Bosque Seco Chiquitano, mediante la comparación morfológica de polen encontrado en las anteras de las flores y en el cuerpo de las abejas en la Reserva Natural Privada Potrerillos del Güendá en las cercanías de la ciudad de Santa Cruz, Bolivia.
Materiales y métodos
Área de estudio
El estudio se realizó en la Reserva Privada Potrerillos del Güendá (Santa Cruz, Bolivia) ubicada en las coordenadas 17°40'16"S 63°27'27"W entre la quebrada La Concha y el río Güendá.
La propiedad tiene un área de 350 Ha, y con terrenos adjuntos suma 1500 Ha de bosque conservado que corresponden al área protegida departamental Unidad de Conservación del Patrimonio Natural Urubó-Güenda (UCPN).
El sitio posee un clima termotropical, ombrotipo pluviestacional, la vegetación del lugar corresponde a bosques de transición entre Amazónico y Bosque Seco Chiquitano (Navarro, 2011).
Registro de abejas nocturnas
Modificando la técnica usada por Cocucci et al. (2009), se capturaron abejas nocturnas con trampas de luz en dos claros de bosque por tres noches consecutivas entre las 20:00 y 22:00.
Se usó una trampa por noche, las dos primeras noches en un mismo claro y la tercera noche en un claro de bosque distinto.
Se colectaron especímenes de cada morfoespecie para su posterior identificación a través de frascos con acetato de etilo. Por otra parte, la mayor parte de los individuos fueron sedados, examinados para colectar muestras de polen de su cuerpo y posteriormente liberados.
Las abejas colectadas fueron montadas e identificadas según las claves de Michenner (2007), Dalmazzo et al. (2015), Santos & Melo (2015) y depositadas en el Museo de Historia Natural Noel Kempff Mercado.
Las fotografías de las abejas registradas en los muestreos fueron subidas a la plataforma iNaturalist (e.g. https://www.inaturalist.org/observations/194441171 y https://www.inaturalist. rg/observations/194457936)
Construcción de una biblioteca palinológica
Se colectaron plantas en flor con polen o néctar accesible para las abejas, en una transecta de 800 m alrededor del lugar y cercanas al río Güendá, de las cuales se obtuvo el polen de las anteras en estado fértil para generar una palinoteca.
Las plantas prensadas se ingresaron al Herbario Nacional Forestal “Martín Cárdenas”.
Se tomaron muestras de polen provenientes de flores y anteras caídas (en el caso de Lythraceae sp.1) debido a la dificultad para acceder a flores frescas por la altura del árbol.
Obtención de las muestras palinológicas
Para extraer el polen de las abejas y de las anteras se utilizó un preparado de gelatina glicerinada con las siguientes proporciones; 10 gr de gelatina disuelta en 30 ml de agua destilada y 30 ml de glicerina al 100%.
Posteriormente se la pasó a una jeringa donde se solidificó. Para usar la gelatina glicerinada se obtuvieron pequeñas porciones a través de la jeringa, las que se impregnaron en las anteras de las plantas colectadas o en el cuerpo de las abejas capturadas, para luego montar cada una de las muestras en portaobjetos que fueron sellados con parafina.
A cada placa montada y sellada con parafina se le realizó un barrido completo en microscopio óptico, en el caso de las plantas se realizó una palinoteca mientras que en el de las abejas se usaron las guías de identificación palinológica de Grant (2000), Colinvaux et al., (2005) y Hesse et al., (2009), para aquellas que no se ecnontraron dentro de la palinoteca hecha con plantas del lugar.
Análisis estadístico
En este estudio observacional se construyó una matriz de la red de interacción con el polen encontrado en el cuerpo de las abejas nocturnas. Luego se analizaron los datos con el software R versión 4.3.2 (R Core Team 2023), donde se obtuvo la red de interacción, la matriz de interacción y sus métricas como la conectancia que cuantifica el número de interacciones por especie, el grado de anidamiento que nos permite saber que tan generalistas son las especies, la medida de especialización y el coeficiente de conglomerado, mediante los paquetes bipartite (Dorman, et al., 2009) y network versión 1.18.2 (Butts, 2015).
Resultados
En las trampas de luz se capturaron 19 abejas nocturnas, de las cuales cuatro fueron colectadas y montadas (Figura 1). Todas pertenecen a la familia Halictidae, tribu Augochlorini, se diferenciaron cuatro especies correspondientes a 2 géneros; Megalopta y un género indeterminado.
De los 19 individuos, nueve fueron de Megalopta sp.1, siete de Megalopta sp.2, dos de un género indeterminado sp.1 y no se encontró polen en la única abeja capturada del género indeterminado sp.2, por lo que para la red de interacción se tomaron en cuenta sólo tres especies de abejas.
El polen recolectado del cuerpo de las abejas nocturnas tuvo coincidencias con cinco de las 19 muestras de polen de plantas; una Acanthaceae, dos de Asteraceae y dos de Lythraceae. Además, se halló polen de una Asteraceae no colectada y 6 morfotipos de polen de plantas no identificadas, en la tabla 1 se muestra la frecuencia relativa del polen encontrado.
La red de interacción cuenta con tres especies de abejas y doce de plantas (figura 2) en la que se observa que Megalopta sp.1 interactúa preferentemente con Lythraceae sp. 1, mientras que Megalopta sp. 2 se relaciona más con el Morfotipo 4. En el caso de Augochlorini sp.1 se encontró lainteracción únicamente con el Morfotipo 6.
La conectancia calculada a través de la suma de enlaces dividida por el total de celdas dentro de la matriz de interacciones (Martínez-Falcón et al, 2019) da un valor de 41.67% que, de acuerdo a Beltrán y Traveset (2018), es un parámetro ligado a la riqueza de especies y, por lo tanto, al tamaño de la red. Cuanto menor es la red, mayor es la conectancia.

Figura 1 Abejas nocturnas, colectadas y montadas en alfiler entomológico 0 a. Vista dorsal de Megalopta sp1. b. Vista lateral de Megalopta sp 1. c. Vista lateral de Megalopta sp 2. d. Vista lateral de Augochlorini sp1.
Tabla 1 Familias, especies y sus frecuencias relativas correspondientes del polen encontrado en el cuerpo de las abejas nocturnas.

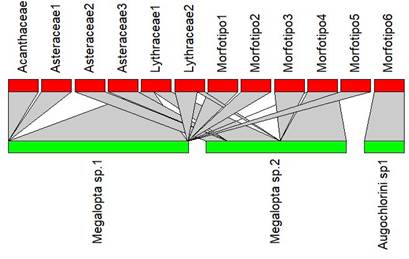
Figura 2 Red bipartida que expone la interacción insecto-planta de Megalopta sp.1, Megalopta sp.2 y Augochlorini sp.1. Se presenta en dos ejes ordenados en función del número decreciente de interacciones. El eje verde corresponde a las abejas y su longitud representa la abundancia de cada especie al momento del muestreo, de acuerdo a sus capturas en la trampa de luz.
El coeficiente de conglomerado de la red es de 0.3333 (los coeficientes de conglomerado promedio de sus miembros). El índice de especialización (H2’) a nivel de red que va entre 0 (sin especialización) y 1 (especialización completa) fue igual a 0.8370, un número que tiende a ser más cercano a 1 lo que indica una alta especialización.
En cuanto a la medida de Anidamiento (nestedness) que va del 0 (alto anidamiento) al 100 (bajo anidamiento o caótico) obtuvimos un valor de 32.5987, que tiende más a 0 que a 100, lo que indica que la red o la matriz es más ordenada que caótica.
El otro índice de anidamiento, NODF, que oscila entre 0 y 100 donde los valores altos indican mayor anidamiento, arrojó un valor de 35.5072. Finalmente, el valor de diversidad de interacciones de Shannon, que al igual que el índice clásico, ayuda a determinar la diversidad, pero en este caso de la diversidad de interacciones que hay dentro de la matriz (Martínez-Falcón et al, 2019), arrojó un valor de 1.5556.
Discusión
La red de interacción obtenida nos da una pequeña aproximación hacia el comportamiento e interacción con plantas de la localidad en un grupo de polinizadores muy poco estudiados como son las abejas nocturnas.
Al aproximarnos a la red de interacción real de estas abejas podemos establecer medidas de conservación de estas especies debido a que además de ser importantes para el ecosistema representan un valor económico importante al polinizar plantas agrícolas como Cucurbitáceas (Cucurbita pepo, C. maxima y C. foetidissima), Mirtáceas (Campomanesia phaea, C. pubescens, Eugenia dysenterica, E. unifiora, Myrciaria fioribunda, etc.), Anacardiaceas (Spondias mombin y S. pinnata) y el Guaraná (Paullinia cupana), (Beltrán y Traveset, 2018; Cordeiro, et al., 2021).
Según Dalmasso et al., (2015), en las tierras bajas tropicales los halictidos son superados en diversidad y abundancia por abejas eusociales sin aguijón (Apidae, Meliponinae), a diferencia de tierra altas donde se presentan un mayor número de especies, sin embargo algunos géneros como Megalopta se presenta en ambientes de selva tropical y son de hábitos crepusculares y nocturnos posiblemente debido a la competencia por recompensas florales que tienen con las Meliponas, de las cuales solo se tiene registro de comportamiento diurno (Engel, 2000; Michener, 2007).
El comportamiento nocturno se ha originado de forma independiente en diferentes linajes de abejas debido a la competencia por los recursos florales ya mencionados, incluso se menciona que la visita nocturna de estas abejas es mucha más antigua que la de otros polinizadores, datando al Oligoceno o Mioceno, provocando una configuración en el entorno floral para otros polinizadores nocturnos, como los murciélagos, dando la apertura de un nuevo nicho (Wcislo, et al., 2004).
Por otro lado, el comportamiento nocturno, así como cleptoparasitismo, se ha originado independientemente varias veces en la familia Halictidae como en el caso del género Sphecodes (Halictini). En la tribu Augochlorini se limitan al género Temnosoma (en Argentina sólo se han citado especies cleptoparásitas de este género) y a un subgénero de Megalopta y Megommation (Michener 2007). Posiblemente el poco o nulo hallazgo de polen en Augochlorini sp.1 y Augochlorini sp.2 se deba a este comportamiento.
Respecto al género MegaloptaWcislo, et al. (2004), menciona que las hembras de Megalopta también recolectan néctar o polen de Solanum, Asplundia, Bactris, Desmoncus, Mimosa, Ipomoea, Spondias, Vismia, Cecropia, Psidium, Acacia, Aegiphila, Chamaedorea, Miconia y Parkia, también Ceiba pentandra, Bombacopsis quinata, Vismia baccifera o Pseudobombax septenatum, usan plantas que tienen antesis tanto nocturna como diurna, por lo que podemos creer que este género es generalista.
Esto coincide con nuestros resultados, donde encontramos polen tanto de Asteraceae, Lythraceae y Acanthaceae.
Sin embargo, puede que la interacción predominante observada entre Lythraceae sp.1 con Megalopta tenga sentido debido a que las flores y anteras fueron colectadas del suelo ya que el árbol era demasiado alto (15 m. aprox) como para recolectarlas de la copa y según Zillikens et al. (2001) todos los halíctidos hacen nidos en el suelo, aunque varias especies se han adaptado a vivir en madera e incluso en los depósitos de sedimentos que se forman entre las hojas de bromelias. En cuanto a los árboles, se sugiere que podrían ser una de las principales fuentes de alimento para las abejas, por su gran porte y su abundante floración .
De acuerdo con Delmas et al. (2019) puede ocurrir que algunas especies exhiban un conjunto mucho mayor de interacciones que otras o formen grupos más densos dentro de la red, lo que se observa en Megalopta sp. 1 y Megalopta sp. 2, debido a que pueden ser generalistas a diferencia de Augochlorini sp. 1.
Sin embargo, se ha probado que el índice de especialización (H2’) puede ser sensible al tamaño de la red por lo que los pocos registros tomados pueden influir en el resultado (Luna et al., 2017; Martínez-Falcón et al., 2019). Debido a esto aún no podemos determinar si Megalopta sp. 1 y Megalopta sp. 2 son más generalistas o si son especialistas.
El patrón visto en la matriz no es de anidamiento perfectamente encajado, sin embargo, tampoco se podría decir que es totalmente aleatorio como se comprobó con la medida de nestedness (32.5987) que es más cercano a 0 (alto anidamiento) que a 100 (bajo anidamiento o caótico).
Se ve que Augochlorini sp.1 y Morfotipo 6 solo interactúan entre sí, lo que difiere con la asimetría de las interacciones ya que las especies especialistas interactúan predominantemente solo con generalistas (Jordano et al., 2009; Mora y Dáttilo, 2021).
La red de interacción descrita en esta investigación es una pequeña muestra de toda la riqueza informativa que puede ofrecer. Aunque el muestreo se realizó durante la época lluviosa, esta se vio afectada por la sequía, lo que resultó en una escasez notable de flores.
Por lo tanto, recomendamos realizar muestreos en diferentes estaciones del año con el fin de obtener una mayor cantidad de información sobre las redes de interacción, considerando la disponibilidad de diferentes recursos para las abejas, así como la posibilidad de encontrar otras especies que también puedan ser importantes en estas interacciones.















